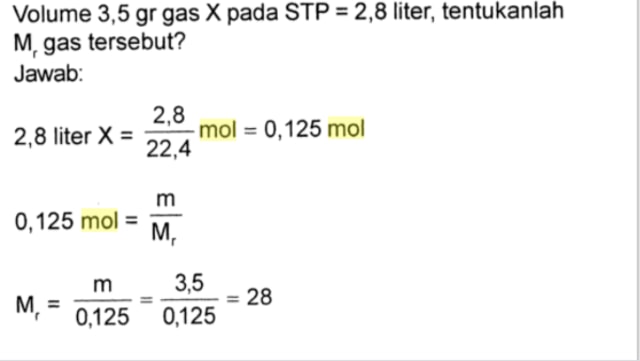
Apakah Anda sedang mempelajari konsep mol dalam pelajaran kimia kelas 10? Jika iya, maka artikel ini adalah sumber informasi yang tepat untuk Anda! Dalam artikel ini, kami akan memberikan kumpulan soal konsep mol dan jawabannya kelas 10 yang lengkap, terperinci, dan mudah dipahami.
Memahami konsep mol adalah hal yang sangat penting dalam mempelajari kimia. Mengapa demikian? Karena konsep mol membantu kita untuk mengukur dan menghitung jumlah partikel dalam suatu zat. Dalam kimia, kita sering kali perlu mengetahui berapa banyak partikel yang terlibat dalam suatu reaksi atau berapa banyak zat yang dibutuhkan untuk mencapai hasil yang diinginkan.
Dalam artikel ini, kita akan mempelajari konsep mol mulai dari pengertian dasar hingga penerapannya dalam berbagai situasi. Setiap sesi akan dilengkapi dengan soal-soal dan jawabannya untuk membantu Anda menguji pemahaman Anda. Mari kita mulai dengan sesi pertama.
Pengertian Mol dan Konsep Dasar
Pada sesi ini, kita akan mempelajari pengertian dasar tentang mol. Apa itu mol? Mol adalah satuan pengukuran yang digunakan dalam kimia untuk mengukur jumlah partikel dalam suatu zat. Satu mol suatu zat mengandung jumlah partikel yang sama dengan jumlah partikel dalam 12 gram karbon-12. Jadi, mol adalah cara bagi kita untuk menghubungkan antara massa zat dengan jumlah partikel yang terkandung di dalamnya.
Massa Molar
Untuk menghitung jumlah mol suatu zat, kita perlu mengetahui massa molar zat tersebut. Massa molar adalah massa zat per mol zat tersebut. Misalnya, massa molar air (H2O) adalah sekitar 18 gram per mol. Jadi, jika kita memiliki 36 gram air, kita dapat menghitung bahwa kita memiliki 2 mol air (36 gram dibagi dengan 18 gram/mol).
Avogadro dan Bilangan Avogadro
Konsep mol didasarkan pada teori yang diajukan oleh Amedeo Avogadro pada abad ke-19. Menurut teori ini, volume gas yang sama pada kondisi yang sama mengandung jumlah partikel yang sama. Jumlah partikel ini dikenal sebagai bilangan Avogadro, yang dinyatakan sebagai 6,022 x 10^23 partikel per mol. Bilangan Avogadro ini sangat penting dalam menghitung jumlah partikel dalam suatu zat.
Perhitungan Mol
Pada sesi ini, kita akan mempelajari cara menghitung jumlah mol suatu zat berdasarkan massa atau volume yang diberikan. Ada dua langkah utama dalam perhitungan mol:
1. Menghitung Jumlah Mol dari Massa
Langkah pertama adalah menghitung jumlah mol suatu zat berdasarkan massa yang diberikan. Untuk melakukan ini, kita perlu mengetahui massa molar zat tersebut. Misalnya, jika kita memiliki 36 gram air dan massa molar air adalah 18 gram/mol, kita dapat menghitung bahwa kita memiliki 2 mol air (36 gram dibagi dengan 18 gram/mol).
2. Menghitung Jumlah Mol dari Volume Gas
Langkah kedua adalah menghitung jumlah mol suatu zat berdasarkan volume gas yang diberikan. Kita dapat menggunakan persamaan umum gas ideal, yaitu PV = nRT, di mana P adalah tekanan gas, V adalah volume gas, n adalah jumlah mol gas, R adalah konstanta gas, dan T adalah suhu gas dalam Kelvin. Dengan menggunakan persamaan ini, kita dapat menghitung jumlah mol gas berdasarkan volume gas yang diberikan.
Hubungan Mol dengan Jumlah Partikel
Pada sesi ini, kita akan mempelajari hubungan antara mol dengan jumlah partikel. Sebagai contoh, kita akan membahas konsep Avogadro dan bagaimana menghitung jumlah partikel berdasarkan jumlah mol.
Konsep Avogadro
Konsep Avogadro menyatakan bahwa jumlah partikel (atom, molekul, ion, dll.) dalam satu mol suatu zat adalah konstan, yaitu 6,022 x 10^23 partikel per mol. Jadi, jika kita memiliki 1 mol oksigen (O2), kita tahu bahwa kita memiliki 6,022 x 10^23 molekul oksigen.
Menghitung Jumlah Partikel dari Jumlah Mol
Untuk menghitung jumlah partikel berdasarkan jumlah mol, kita dapat menggunakan bilangan Avogadro. Misalnya, jika kita memiliki 2 mol karbon dioksida (CO2), kita dapat menghitung bahwa kita memiliki 1,2044 x 10^24 molekul karbon dioksida (2 mol dikalikan dengan 6,022 x 10^23 molekul/mol).
Stoikiometri
Stoikiometri adalah bagian penting dalam konsep mol. Stoikiometri membantu kita untuk menghubungkan antara jumlah mol suatu zat dengan jumlah mol zat lain dalam suatu reaksi kimia. Pada sesi ini, kita akan mempelajari bagaimana menggunakan perbandingan mol untuk menghitung jumlah zat dalam reaksi kimia.
Perbandingan Mol dalam Reaksi Kimia
Setiap reaksi kimia memiliki perbandingan mol yang unik. Perbandingan mol ini dapat digunakan untuk menghitung jumlah zat yang terlibat dalam reaksi. Misalnya, dalam reaksi pembakaran metana (CH4) dengan oksigen (O2), perbandingan molnya adalah 1:2. Artinya, setiap 1 mol metana akan bereaksi dengan 2 mol oksigen. Dengan menggunakan perbandingan mol ini, kita dapat menghitung jumlah oksigen yang dibutuhkan jika kita memiliki jumlah mol metana yang diberikan.
Contoh Soal Stoikiometri
Untuk memahami konsep stoikiometri dengan lebih baik, mari kita lihat contoh soal stoikiometri. Misalnya, jika kita memiliki 2 mol natrium hidroksida (NaOH) dan reaksi yang terjadi adalah dengan asam sulfat (H2SO4), kita dapat menggunakan perbandingan mol untuk menghitung jumlah asam sulfat yang bereaksi dengan natrium hidroksida.
Konversi Satuan Mol
Pada sesi ini, kita akan mempelajari cara mengkonversi jumlah mol ke satuan lain seperti gram atau liter. Mengapa konversi satuan mol penting? Karena dalam praktiknya, kita sering kali perlu mengubah satuan jumlah mol menjadi satuan lain yang lebih mudah dipahami atau digunakan.
Mengkonversi Jumlah Mol menjadi Gram
Untuk mengkonversi jumlah mol menjadi gram, kita perlu mengetahui massa molar zat tersebut. Misalnya, jika kita memiliki 2 mol air (H2O) dan massa molar air adalah 18 gram/mol, kita dapat menghitung bahwa kita memiliki 36 gram air (2 mol dikalikan dengan 18 gram/mol).
Mengkonversi Jumlah Mol menjadi Liter
Untuk mengkonversi jumlah mol menjadi liter, kita perlu mengetahui volume molar gas (Vm). Volume molar gas adalah volume yang ditempati oleh satu mol gas pada kondisi standar (tekanan 1 atm dan suhu 273 Kelvin). Misalnya, jika kita memiliki 2 mol gas dan volume molar gas adalah 22,4 liter/mol, kita dapat menghitung bahwa kita memiliki 44,8 liter gas (2 mol dikalikan dengan 22,4 liter/mol).
Mol dalam Larutan
Pada sesi ini, kita akan mempelajari konsep mol dalam larutan. Bagaimana menghitung konsentrasi mol larutan? Bagaimana menentukan jumlah mol suatu zat dalam larutan? Mari kita cari tahu.
Konsentrasi Mol Larutan
Konsentrasi mol larutan mengukur jumlah mol zat terlarut dalam satu liter larutan. Konsentrasi mol dapat dihitungdengan menggunakan rumus konsentrasi mol, yaitu:
Konsentrasi Mol (M) = Jumlah Mol Zat Terlarut / Volume Larutan (dalam liter)
Misalnya, jika kita memiliki 0,5 mol garam dapur (NaCl) dalam 1 liter larutan, maka konsentrasi mol larutan tersebut adalah 0,5 M.
Menghitung Jumlah Mol dalam Larutan
Untuk menghitung jumlah mol suatu zat dalam larutan, kita dapat menggunakan rumus konsentrasi mol yang telah kita pelajari sebelumnya. Misalnya, jika kita memiliki larutan dengan konsentrasi mol 0,2 M dan volume larutan 0,5 liter, kita dapat menghitung jumlah mol zat terlarut dengan mengalikan konsentrasi mol dengan volume larutan:Jumlah Mol Zat Terlarut = Konsentrasi Mol x Volume Larutan
Dalam contoh ini, jumlah mol zat terlarut adalah 0,2 mol x 0,5 liter = 0,1 mol.
Mol dalam Gas
Dalam sesi ini, kita akan mempelajari konsep mol dalam gas. Bagaimana menghitung volume gas berdasarkan jumlah mol yang diberikan?Hubungan Antara Mol, Volume, dan Tekanan Gas
Menurut hukum gas ideal, volume gas (V) berbanding lurus dengan jumlah mol gas (n) pada suhu dan tekanan yang konstan. Artinya, jika jumlah mol gas diperbesar, volume gas juga akan diperbesar, dan sebaliknya. Selain itu, terdapat hubungan antara volume gas, jumlah mol gas, dan tekanan gas, yang dinyatakan dalam persamaan gas ideal:PV = nRT
Di mana P adalah tekanan gas, V adalah volume gas, n adalah jumlah mol gas, R adalah konstanta gas, dan T adalah suhu gas dalam Kelvin.
Menghitung Volume Gas berdasarkan Jumlah Mol
Dengan menggunakan persamaan gas ideal, kita dapat menghitung volume gas berdasarkan jumlah mol yang diberikan. Misalnya, jika kita memiliki 2 mol gas pada suhu 273 Kelvin dan tekanan 1 atm, kita dapat menggunakan konstanta gas R (0,0821 L.atm/mol.K) untuk menghitung volume gas:V = nRT / P= 2 mol x 0,0821 L.atm/mol.K x 273 K / 1 atm= 44,9 L
Jadi, jika kita memiliki 2 mol gas pada suhu 273 Kelvin dan tekanan 1 atm, volume gasnya adalah 44,9 liter.
Mol dalam Padatan
Sesi ini akan membahas tentang konsep mol dalam padatan. Bagaimana menghitung jumlah mol suatu zat dalam padatan berdasarkan massa yang diberikan?Massa Molar Padatan
Sebelum kita dapat menghitung jumlah mol suatu zat dalam padatan, kita perlu mengetahui massa molar padatan tersebut. Massa molar adalah massa zat per mol zat tersebut. Misalnya, massa molar natrium klorida (NaCl) adalah sekitar 58,5 gram per mol. Jadi, jika kita memiliki 117 gram natrium klorida, kita dapat menghitung jumlah molnya:Jumlah Mol Zat = Massa Zat / Massa Molar Zat= 117 gram / 58,5 gram/mol= 2 mol
Jadi, jika kita memiliki 117 gram natrium klorida, kita memiliki 2 mol natrium klorida.
Menghitung Massa Padatan berdasarkan Jumlah Mol
Kita juga dapat melakukan kebalikan dari perhitungan sebelumnya, yaitu menghitung massa padatan berdasarkan jumlah mol yang diberikan. Misalnya, jika kita memiliki 3 mol tembaga (Cu), kita dapat menghitung massa tembaga dengan mengalikan jumlah mol dengan massa molar tembaga:Massa Zat = Jumlah Mol Zat x Massa Molar Zat= 3 mol x 63,5 gram/mol= 190,5 gram
Jadi, jika kita memiliki 3 mol tembaga, massa tembaganya adalah 190,5 gram.
Mol dalam Reaksi Kimia
Reaksi kimia sering melibatkan perubahan jumlah mol. Dalam sesi ini, kita akan melihat contoh soal reaksi kimia dan bagaimana menghitung perubahan jumlah mol dalam suatu reaksi.Perubahan Jumlah Mol dalam Reaksi Kimia
Dalam reaksi kimia, jumlah mol zat-zat yang terlibat dalam reaksi dapat berubah. Misalnya, jika kita memiliki reaksi pembakaran metana (CH4) dengan oksigen (O2), reaksinya adalah sebagai berikut:CH4 + 2O2 -> CO2 + 2H2O
Dalam reaksi ini, setiap 1 mol metana akan bereaksi dengan 2 mol oksigen. Jadi, jika kita memiliki 2 mol metana, berapa mol oksigen yang dibutuhkan?
Jumlah Mol Oksigen = 2 mol metana x (2 mol oksigen / 1 mol metana)= 4 mol oksigen
Jadi, jika kita memiliki 2 mol metana, kita membutuhkan 4 mol oksigen dalam reaksi tersebut.
Latihan Soal
Pada sesi terakhir, kita akan menyediakan latihan soal konsep mol dan jawabannya. Latihan soal ini akan membantu Anda menguji pemahaman Anda setelah membaca artikel ini. Jangan ragu untuk mencoba latihan soal ini dan melihat sejauh mana pemahaman Anda tentang konsep mol dalam kimia kelas 10.Dalam kesimpulan, memahami konsep mol adalah langkah penting dalam mempelajari kimia kelas 10. Dalam artikel ini, kita telah membahas pengertian dasar mol, perhitungan mol, hubungan mol dengan jumlah partikel, stoikiometri, konversi satuan mol, mol dalam larutan, gas, dan padatan, serta perubahan jumlah mol dalam reaksi kimia. Semoga artikel ini dapat membantu Anda memahami konsep mol dengan lebih baik. Jika Anda memiliki pertanyaan lebih lanjut, jangan ragu untuk menanyakan kepada guru atau teman sekelas Anda. Selamat belajar!
