Apakah Anda pernah mendengar tentang elektrokimia? Elektrokimia adalah cabang ilmu kimia yang mempelajari hubungan antara reaksi kimia dan aliran listrik. Dalam elektrokimia, zat kimia dapat diubah menjadi energi listrik atau sebaliknya. Konsep ini telah diterapkan dalam berbagai bidang, seperti pembuatan baterai, pemurnian logam, dan elektrolisis.
Proses elektrokimia melibatkan reaksi redoks, di mana terjadi perubahan dalam muatan listrik suatu zat. Pada elektrokimia, ada dua jenis sel elektrokimia yang umum digunakan, yaitu sel volta dan sel elektrolisis. Sel volta menghasilkan listrik dari reaksi kimia, sedangkan sel elektrolisis menggunakan listrik untuk menghasilkan reaksi kimia.
Elektrokimia Dasar
Dalam elektrokimia dasar, terdapat beberapa konsep penting yang perlu dipahami. Salah satunya adalah hukum Faraday, yang menyatakan bahwa jumlah zat yang terlibat dalam reaksi elektrokimia terkait dengan jumlah arus listrik yang melewatinya. Hukum Faraday menjelaskan hubungan antara muatan listrik, jumlah zat, dan waktu. Dengan memahami hukum Faraday, kita dapat menghitung jumlah zat yang terlibat dalam reaksi elektrokimia.
Hukum Faraday
Hukum Faraday menyatakan bahwa jumlah zat yang terlibat dalam reaksi elektrokimia sebanding dengan jumlah arus listrik yang melewatinya. Jika Q adalah jumlah muatan listrik yang melewati suatu titik dalam rangkaian, maka jumlah zat yang terlibat dalam reaksi elektrokimia dapat dihitung dengan menggunakan persamaan:
n = Q / F
Di mana n adalah jumlah mol zat yang terlibat, Q adalah jumlah muatan listrik yang melewati titik tersebut, dan F adalah konstanta Faraday yang bernilai sekitar 96.485 C/mol. Dengan menggunakan hukum Faraday, kita dapat menghitung jumlah zat yang terlibat dalam reaksi elektrokimia berdasarkan jumlah arus listrik yang digunakan.
Sel Volta dan Sel Elektrolisis
Dalam elektrokimia, terdapat dua jenis sel elektrokimia yang umum digunakan, yaitu sel volta dan sel elektrolisis. Sel volta adalah jenis sel elektrokimia yang menghasilkan listrik dari reaksi kimia. Sel volta terdiri dari dua elektroda yang terendam dalam larutan elektrolit. Ketika elektroda terhubung melalui kawat penghantar, terjadi reaksi redoks di elektroda, yang menghasilkan aliran elektron melalui kawat penghantar. Contoh sel volta yang umum digunakan adalah baterai.
Sel elektrolisis, di sisi lain, menggunakan listrik untuk memaksa terjadinya reaksi kimia. Sel elektrolisis juga terdiri dari dua elektroda yang terendam dalam larutan elektrolit. Namun, perbedaannya adalah arus listrik diberikan secara eksternal untuk mendorong terjadinya reaksi redoks. Sel elektrolisis digunakan dalam proses elektrolisis, di mana zat kimia dapat diuraikan atau dideposisikan pada elektroda.
Reaksi Redoks
Reaksi redoks adalah bagian penting dari elektrokimia. Reaksi redoks melibatkan transfer elektron dari satu zat ke zat lainnya. Dalam reaksi redoks, terdapat dua jenis reaksi yang terjadi secara simultan, yaitu oksidasi dan reduksi. Oksidasi adalah reaksi di mana suatu zat kehilangan elektron, sedangkan reduksi adalah reaksi di mana suatu zat mendapatkan elektron.
Oksidasi dan Reduksi
Oksidasi dan reduksi adalah dua proses yang terjadi bersamaan dalam suatu reaksi redoks. Oksidasi adalah proses di mana zat kehilangan elektron. Misalnya, jika besi bereaksi dengan oksigen, besi akan kehilangan elektron dan teroksidasi menjadi besi(III) oksida (Fe2O3). Reduksi, di sisi lain, adalah proses di mana zat mendapatkan elektron. Dalam contoh sebelumnya, oksigen menerima elektron dan direduksi menjadi ion oksida (O2-). Oksidasi dan reduksi selalu terjadi bersamaan dalam reaksi redoks.
Reaksi Redoks dan Elektrokimia
Reaksi redoks sangat penting dalam elektrokimia. Pada dasarnya, elektrokimia melibatkan reaksi redoks yang diinduksi oleh aliran listrik. Ketika arus listrik mengalir melalui sel elektrokimia, terjadi oksidasi dan reduksi di elektroda. Misalnya, dalam sel volta, oksidasi terjadi di anoda, di mana zat diubah menjadi ion positif dan kehilangan elektron. Di sisi lain, reduksi terjadi di katoda, di mana ion positif menerima elektron dan tereduksi menjadi zat netral. Proses ini menghasilkan aliran elektron melalui kawat penghantar, yang dapat digunakan untuk menghasilkan listrik.
Potensial Elektrokimia
Potensial elektrokimia merupakan ukuran dari kemampuan suatu zat untuk menerima atau melepaskan elektron dalam suatu sel elektrokimia. Potensial elektrokimia dapat digunakan untuk memprediksi arah aliran elektron dalam suatu reaksi redoks. Potensial elektrokimia diukur dalam satuan volt (V).
Reaksi Redoks dan Potensial Elektrokimia
Pada dasarnya, potensial elektrokimia terkait dengan perbedaan kecenderungan oksidasi-reduksi antara dua zat dalam suatu reaksi redoks. Zat dengan kecenderungan oksidasi yang lebih tinggi akan melepaskan elektron dan menjadi oksidator, sedangkan zat dengan kecenderungan reduksi yang lebih tinggi akan menerima elektron dan menjadi reduktor. Perbedaan potensial elektrokimia antara oksidator dan reduktor menentukan arah aliran elektron dalam suatu reaksi redoks.
Potensial Standar
Potensial elektrokimia sering kali diukur dengan membandingkannya dengan elektroda standar yang memiliki potensial nol. Potensial standar adalah potensial elektrokimia suatu zat ketika konsentrasi zat tersebut adalah 1 mol/L dan tekanan adalah 1 atm. Potensial standar digunakan sebagai acuan untuk mengukur potensial elektrokimia zat lain. Perbedaan potensial antara elektroda yang sedang diamati dengan elektroda standar menunjukkan potensial elektrokimia zat tersebut.
Sel Elektrokimia
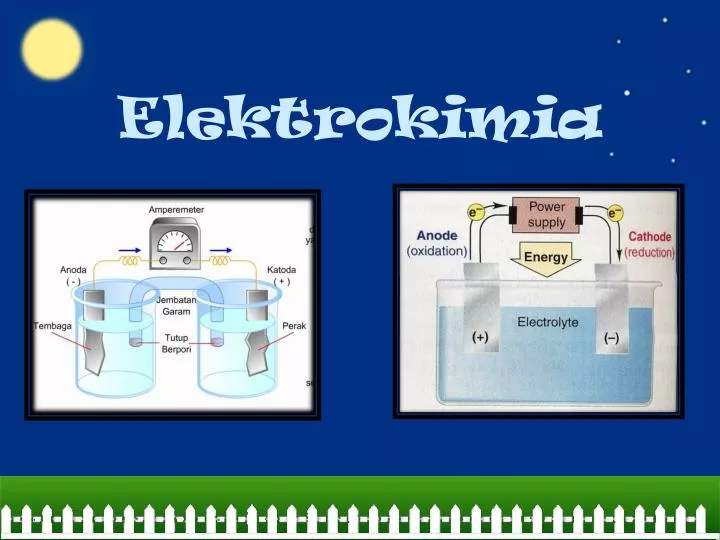
Sel elektrokimia adalah perangkat yang menghasilkan atau menggunakan energi listrik melalui reaksi kimia. Sel elektrokimia terdiri dari dua elektroda yang terendam dalam larutan elektrolit. Elektroda terhubung melalui kawat penghantar, yang memungkinkan aliran elektron. Sel elektrokimia dapat digunakan untuk menghasilkan listrik dalam sel volta atau untuk melakukan reaksi kimia dalam sel elektrolisis.
Bagian-bagian Sel Elektrokimia
Sel elektrokimia terdiri dari beberapa bagian penting. Pertama, terdapat anoda, yang merupakan elektroda di mana oksidasi terjadi. Anoda umumnya terhubung dengan kutub negatif sumber listrik eksternal. Kedua, terdapat katoda, yang merupakan elektroda di mana reduksi terjadi. Katoda umumnya terhubung dengan kutub positif sumber listrik eksternal. Ketiga,terdapat larutan elektrolit, yang berfungsi sebagai penghantar ion untuk memungkinkan terjadinya reaksi redoks. Larutan elektrolit dapat berupa cairan, padatan, atau bahkan gas terionisasi. Keempat, terdapat kawat penghantar, yang menghubungkan anoda dan katoda, memungkinkan aliran elektron dalam sel elektrokimia. Terakhir, terdapat sumber listrik eksternal, seperti baterai atau generator, yang menyediakan energi listrik untuk mendorong terjadinya reaksi redoks dalam sel elektrokimia.
Sel Volta
Sel volta adalah jenis sel elektrokimia yang menghasilkan listrik dari reaksi kimia. Sel volta terdiri dari dua komponen penting, yaitu anoda dan katoda. Anoda adalah elektroda di mana oksidasi terjadi, sedangkan katoda adalah elektroda di mana reduksi terjadi. Reaksi redoks di kedua elektroda menghasilkan aliran elektron melalui kawat penghantar, yang dapat digunakan untuk menghasilkan listrik. Contoh sel volta yang umum digunakan adalah baterai, di mana reaksi kimia antara elektroda dan larutan elektrolit menghasilkan energi listrik yang dapat digunakan untuk mengoperasikan perangkat elektronik.
Sel Elektrolisis
Sel elektrolisis adalah jenis sel elektrokimia yang menggunakan listrik untuk memaksa terjadinya reaksi kimia. Sel elektrolisis juga terdiri dari anoda dan katoda, tetapi perbedaannya adalah arus listrik diberikan secara eksternal melalui sumber listrik eksternal. Arus listrik ini memaksa terjadinya reaksi redoks di kedua elektroda. Contoh penggunaan sel elektrolisis adalah dalam proses elektrolisis air, di mana arus listrik digunakan untuk memisahkan air menjadi oksigen dan hidrogen.
Baterai dan Sel Galvani
Baterai adalah contoh penerapan elektrokimia dalam kehidupan sehari-hari. Baterai adalah perangkat yang menghasilkan energi listrik dari reaksi kimia di dalamnya. Baterai terdiri dari dua elektroda, yaitu anoda dan katoda, yang terendam dalam larutan elektrolit. Reaksi redoks pada elektroda menghasilkan aliran elektron melalui kawat penghantar, yang dapat digunakan untuk mengoperasikan perangkat elektronik. Baterai dapat digunakan dalam berbagai aplikasi, mulai dari perangkat elektronik portabel hingga kendaraan listrik.
Sel Galvani
Sel galvani adalah salah satu bentuk awal baterai. Sel galvani pertama kali ditemukan oleh Luigi Galvani pada abad ke-18. Sel galvani terdiri dari dua elektroda yang terbuat dari logam yang berbeda dan terhubung melalui larutan elektrolit. Reaksi redoks antara elektroda dan larutan elektrolit menghasilkan aliran elektron dan menghasilkan energi listrik. Contoh sel galvani yang terkenal adalah sel Volta, yang merupakan baterai pertama yang dapat menghasilkan energi listrik secara praktis.
Elektrolisis
Elektrolisis adalah proses elektrokimia di mana zat kimia diuraikan atau dideposisikan menggunakan arus listrik eksternal. Dalam elektrolisis, arus listrik digunakan untuk memaksa terjadinya reaksi redoks di elektroda. Elektrolisis memiliki berbagai aplikasi, termasuk dalam produksi logam, pemurnian logam, dan sintesis zat kimia.
Prinsip Elektrolisis
Elektrolisis didasarkan pada prinsip bahwa arus listrik dapat digunakan untuk memaksa terjadinya reaksi redoks yang tidak akan terjadi secara spontan. Arus listrik ini menghasilkan energi yang cukup untuk mengatasi hambatan dalam reaksi redoks dan memaksa terjadinya reaksi tersebut di elektroda. Misalnya, dalam proses elektrolisis air, arus listrik digunakan untuk memisahkan molekul air menjadi oksigen dan hidrogen.
Aplikasi Elektrolisis
Elektrolisis memiliki berbagai aplikasi dalam industri. Salah satu aplikasi yang umum adalah dalam produksi logam. Beberapa logam seperti aluminium dan tembaga diproduksi melalui proses elektrolisis. Selain itu, elektrolisis juga digunakan dalam pemurnian logam, di mana logam yang terkontaminasi diuraikan dan dipisahkan dari logam murni. Elektrolisis juga digunakan dalam sintesis zat kimia, di mana reaksi kimia yang sulit dilakukan secara konvensional dapat dipercepat dengan bantuan arus listrik.
Korosi
Korosi adalah proses elektrokimia di mana logam diubah menjadi oksida atau senyawa lain akibat reaksi dengan zat di sekitarnya. Korosi adalah masalah umum yang sering terjadi pada logam yang terkena air dan udara. Proses korosi melibatkan reaksi redoks di mana logam teroksidasi dan mengalami kerusakan.
Penyebab Korosi
Korosi dapat disebabkan oleh berbagai faktor. Salah satu faktor utama adalah kelembaban. Ketika logam terkena air atau kelembaban, reaksi redoks antara logam dan air terjadi, menghasilkan oksida logam atau senyawa lain yang tidak diinginkan. Selain itu, korosi juga dapat disebabkan oleh adanya zat korosif, seperti garam atau asam, yang mempercepat reaksi redoks dan kerusakan logam.
Pencegahan Korosi
Untuk mencegah korosi, beberapa langkah pencegahan dapat diambil. Salah satunya adalah pelapisan atau pengecatan logam dengan lapisan pelindung, seperti cat atau lapisan anti karat. Pelapisan ini dapat mencegah logam dari kontak langsung dengan zat korosif. Selain itu, teknik elektrokimia seperti galvanisasi juga dapat digunakan untuk melindungi logam. Dalam galvanisasi, logam yang lebih mudah teroksidasi dilapisi dengan logam yang lebih tahan terhadap korosi, membentuk lapisan pelindung.
Elektrokimia dan Lingkungan
Elektrokimia memiliki dampak pada lingkungan sekitar kita. Beberapa aplikasi elektrokimia dapat berkontribusi pada pencemaran lingkungan, sementara yang lain dapat membantu mengurangi dampak negatif pada lingkungan.
Pengaruh Elektrokimia terhadap Lingkungan
Beberapa aplikasi elektrokimia dapat berkontribusi pada pencemaran lingkungan. Misalnya, dalam industri kimia, elektrokimia digunakan dalam proses produksi yang dapat menghasilkan limbah berbahaya. Limbah elektrokimia dapat mengandung logam berat atau senyawa kimia beracun yang dapat mencemari air, tanah, dan udara. Selain itu, proses elektrolisis juga dapat menggunakan energi listrik dari sumber yang tidak ramah lingkungan, seperti pembangkit listrik berbasis fosil.
Upaya Mengurangi Dampak Negatif
Meskipun elektrokimia dapat memiliki dampak negatif pada lingkungan, upaya telah dilakukan untuk mengurangi dampak tersebut. Salah satu upaya adalah pengembangan teknologi yang lebih efisien dan ramah lingkungan. Misalnya, penggunaan sumber energi terbarukan, seperti energi surya atau energi angin, untuk menghasilkan listrik yang digunakan dalam elektrokimia. Selain itu, perbaikan dalam proses elektrolisis dan manajemen limbah juga terus dilakukan untuk mengurangi dampak negatif pada lingkungan.
Aplikasi Elektrokimia dalam Industri
Elektrokimia memiliki berbagai aplikasi dalam industri, yang meliputi produksi logam, pembuatan bahan kimia, dan proses pemurnian. Aplikasi elektrokimia dalam industri tidak hanya memberikan manfaat dalam produksi, tetapi juga dapat menghasilkan produk yang lebih berkualitas dan ramah lingkungan.
Elektroplating
Salah satu aplikasi elektrokimia yang umum dalam industri adalah elektroplating. Elektroplating adalah proses yang menggunakan elektrokimia untuk melapisi benda dengan lapisan logam. Proses ini melibatkan penggunaan sel elektrokimia, di mana logam yang akan dilapisi bertindak sebagai katoda dan logam pelapis bertindak sebagai anoda. Arus listrik kemudian dialirkan melalui sel, menyebabkan ion logam pelapis terdeposisi pada permukaan benda yang akan dilapisi. Elektroplating digunakan dalam industri manufaktur untuk melapisi benda-benda seperti perhiasan, komponen elektronik, atau bahan bangunan dengan lapisan logam yang tahan karat dan memberikan tampilan yang menarik.
Produksi Klorin
Elektrokimia juga digunakan dalam industri kimia untuk produksi klorin. Proses ini dikenal sebagai proses klor-alkali dan melibatkan elektrolisis larutan garam meja (natrium klorida) atau air laut. Dalam sel elektrokimia, klorin diproduksi di anoda, sedangkan hidrogen diproduksi di katoda. Proses ini memungkinkan produksi klorin yang digunakan dalam berbagai aplikasi industri, seperti pembuatan bahan kimia, pemutihan pulp dan kertas, dan pemurnian air.
Pemurnian Logam
Elektrokimia juga digunakan dalam proses pemurnian logam. Salah satu contoh adalah proses pemurnian tembaga. Tembaga yang mengandung logam-logam lain diuraikan melalui elektrolisis. Tembaga berfungsi sebagai anoda dalam sel elektrokimia, sedangkan logam-logam lain yang terkandung dalam tembaga berfungsi sebagai katoda. Arus listrik dialirkan melalui sel, menyebabkan logam-logam lain terendapkan pada katoda dan tembaga murni terkumpul di anoda. Proses pemurnian logam ini menghasilkan tembaga dengan tingkat kemurnian yang tinggi, yang dapat digunakan dalam berbagai industri seperti elektronik, konstruksi, dan manufaktur.
Penelitian dan Perkembangan Terkini dalam Elektrokimia
Elektrokimia terus mengalami penelitian dan perkembangan yang menarik. Para ilmuwan terus mencari cara baru untuk memahami dan memanfaatkan prinsip elektrokimia untuk aplikasi yang lebih canggih dan efisien.
Pengembangan Sel Bahan Bakar
Salah satu tren penelitian terkini dalam elektrokimia adalah pengembangan sel bahan bakar. Sel bahan bakar adalah perangkat elektrokimia yang menghasilkan energi listrik dengan mengonversi energi kimia menjadi energi listrik. Sel bahan bakar menggunakan reaksi oksidasi-reduksi untuk menghasilkan aliran elektron melalui katalis, yang kemudian digunakan untuk menghasilkan listrik. Sel bahan bakar memiliki potensi sebagai sumber energi alternatif yang ramah lingkungan dan efisien, dan penelitian terus dilakukan untuk meningkatkan efisiensi dan daya tahan sel bahan bakar.
Penyimpanan Energi
Penyimpanan energi adalah bidang lain dalam elektrokimia yang sedang mendapatkan perhatian besar. Dalam era peningkatan penggunaan energi terbarukan, penyimpanan energi menjadi kunci untuk memanfaatkan energi tersebut secara efisien. Elektrokimia memainkan peran penting dalam pengembangan teknologi penyimpanan energi, seperti baterai litium-ion yang digunakan dalam kendaraan listrik dan sistem penyimpanan energi rumah tangga. Penelitian terus dilakukan untuk meningkatkan kapasitas, kecepatan pengisian, dan keamanan baterai serta mengembangkan teknologi penyimpanan energi yang lebih efisien dan ramah lingkungan.
Dalam kesimpulan, elektrokimia adalah cabang ilmu kimia yang mempelajari hubungan antara reaksi kimia dan aliran listrik. Dalam artikel ini, kita telah menjelaskan konsep dasar elektrokimia, reaksi redoks, sel elektrokimia, dan berbagai aplikasi dalam kehidupan sehari-hari dan industri. Kita juga membahas pengaruh elektrokimia terhadap lingkungan dan perkembangan terkini dalam bidang ini. Dengan pemahaman yang lebih baik tentang elektrokimia, kita dapat mengembangkan teknologi yang lebih efisien, ramah lingkungan, dan inovatif dalam berbagai bidang industri dan penelitian.
