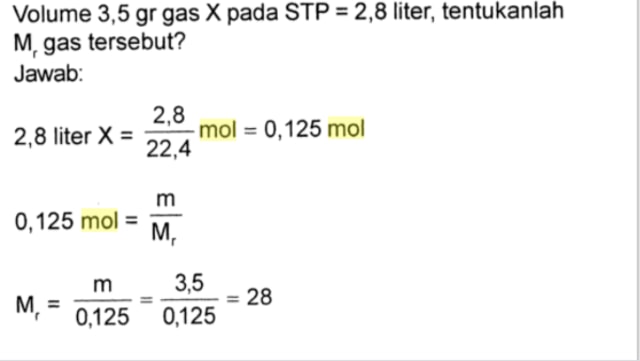
Soal konsep mol dan jawabannya menjadi topik yang menarik untuk dibahas dalam artikel ini. Konsep mol merupakan salah satu teori dasar dalam kimia yang berkaitan dengan pengukuran jumlah partikel dalam suatu zat. Dalam artikel ini, kita akan menjelajahi konsep mol secara mendalam dan memberikan jawaban terperinci untuk berbagai pertanyaan seputar hal ini.
Pengenalan Konsep Mol
Apa itu Mol?
Pengenalan konsep mol merupakan langkah pertama yang perlu dipahami. Mol adalah satuan pengukuran jumlah partikel, seperti atom, molekul, atau ion dalam suatu zat. Satu mol suatu zat mengandung jumlah partikel yang sama dengan jumlah atom dalam 12 gram karbon-12. Dengan menggunakan konsep mol, kita dapat menghubungkan antara massa suatu zat dengan jumlah partikelnya.
Pentingnya Konsep Mol dalam Kimia
Konsep mol sangat penting dalam kimia karena memungkinkan kita untuk mengukur dan memahami jumlah partikel dalam suatu zat. Dengan menggunakan konsep mol, kita dapat menghitung berbagai parameter penting seperti massa, volume, dan jumlah partikel dalam suatu reaksi kimia. Selain itu, konsep mol juga membantu dalam perhitungan stoikiometri, yaitu hubungan antara jumlah partikel yang terlibat dalam suatu reaksi kimia.
Cara Menghitung Jumlah Partikel dalam Satu Mol Zat
Untuk menghitung jumlah partikel dalam satu mol suatu zat, kita perlu menggunakan konstanta Avogadro. Konstanta Avogadro (NA) memiliki nilai sekitar 6,022 x 10^23, yang merupakan perkiraan jumlah partikel dalam satu mol. Untuk menghitung jumlah partikel, kita cukup mengalikan jumlah mol dengan konstanta Avogadro.
Contoh Soal Pengenalan Konsep Mol
Contoh soal yang akan kita bahas dalam bagian ini adalah sebagai berikut:
1. Berapa jumlah atom dalam 2 mol karbon dioksida (CO2)?
Jawab:
Jumlah atom dalam 2 mol CO2 dapat dihitung dengan menggunakan konstanta Avogadro. Kita tahu bahwa satu mol CO2 mengandung 3 atom (1 atom karbon dan 2 atom oksigen). Jadi, jumlah atom dalam 2 mol CO2 adalah:
2 mol x 3 atom/mol = 6 atom
2. Berapa jumlah molekul dalam 0,5 mol air (H2O)?
Jawab:
Jumlah molekul dalam 0,5 mol air (H2O) dapat dihitung dengan menggunakan konstanta Avogadro. Kita tahu bahwa satu mol air mengandung 6,022 x 10^23 molekul. Jadi, jumlah molekul dalam 0,5 mol air adalah:
0,5 mol x 6,022 x 10^23 molekul/mol = 3,011 x 10^23 molekul
Rumus Mol
Rumus Mol untuk Atom dan Molekul
Rumus mol digunakan untuk menghitung jumlah partikel dalam satu mol suatu zat. Untuk atom, rumus mol adalah sebagai berikut:
Jumlah Atom = Jumlah Mol x Avogadro's Number (NA)
Contoh penggunaan rumus mol untuk atom:
Jika kita memiliki 2 mol atom oksigen (O), berapa jumlah atom yang ada?
Jawab:
Jumlah atom dalam 2 mol atom oksigen dapat dihitung dengan menggunakan rumus mol:
Jumlah Atom = 2 mol x 6,022 x 10^23 atom/mol = 1,2044 x 10^24 atom
Untuk molekul, rumus mol adalah sebagai berikut:
Jumlah Molekul = Jumlah Mol x Avogadro's Number (NA)
Contoh penggunaan rumus mol untuk molekul:
Jika kita memiliki 1,5 mol molekul air (H2O), berapa jumlah molekul yang ada?
Jawab:
Jumlah molekul dalam 1,5 mol molekul air dapat dihitung dengan menggunakan rumus mol:
Jumlah Molekul = 1,5 mol x 6,022 x 10^23 molekul/mol = 9,033 x 10^23 molekul
Contoh Soal Rumus Mol
Contoh soal yang akan kita bahas dalam bagian ini adalah sebagai berikut:
1. Berapa jumlah atom dalam 3 mol atom hidrogen (H)?
Jawab:
Jumlah atom dalam 3 mol atom hidrogen dapat dihitung dengan menggunakan rumus mol:
Jumlah Atom = 3 mol x 6,022 x 10^23 atom/mol = 1,8066 x 10^24 atom
2. Berapa jumlah molekul dalam 0,25 mol karbon dioksida (CO2)?
Jawab:
Jumlah molekul dalam 0,25 mol karbon dioksida dapat dihitung dengan menggunakan rumus mol:
Jumlah Molekul = 0,25 mol x 6,022 x 10^23 molekul/mol = 1,5055 x 10^23 molekul
Konversi Mol ke Gram
Cara Mengkonversi Jumlah Mol ke Gram
Untuk mengkonversi jumlah mol suatu zat menjadi massa dalam gram, kita perlu menggunakan massa molar zat tersebut. Massa molar adalah massa satu mol suatu zat dan dinyatakan dalam gram/mol. Untuk mengkonversi jumlah mol ke gram, kita cukup mengalikan jumlah mol dengan massa molar.
Massa = Jumlah Mol x Massa Molar
Contoh penggunaan konversi mol ke gram:
Jika kita memiliki 2 mol karbon dioksida (CO2), berapa massa karbon dioksida dalam gram?
Jawab:
Massa karbon dioksida dalam gram dapat dihitung dengan menggunakan konversi mol ke gram:
Massa = 2 mol x 44 gram/mol = 88 gram
Contoh Soal Konversi Mol ke Gram
Contoh soal yang akan kita bahas dalam bagian ini adalah sebagai berikut:
1. Berapa massa dalam gram dari 3 mol air (H2O)?
Jawab:
Massa air dalam gram dapat dihitung dengan menggunakan konversi mol ke gram:
Massa = 3 mol x 18 gram/mol = 54 gram
2. Berapa massa dalam gram dari 0,5 mol natrium klorida (NaCl)?
Jawab:
Massa natrium klorida dalam gram dapat dihitung dengan menggunakan konversi mol ke gram:
Massa = 0,5 mol x 58,5 gram/mol = 29,25 gram
Konversi Mol ke Volume
Cara Mengkonversi Jumlah Mol ke Volume
Untuk mengkonversi jumlah mol suatu zat menjadi volume dalam liter, kita perlu menggunakan volume molar zat tersebut. Volume molar adalah volume satu mol suatu zat dan dinyatakan dalam liter/mol. Untuk mengkonversi jumlah mol ke volume, kita cukup mengalikan jumlah mol dengan volume molar.
Volume = Jumlah Mol x Volume Molar
Contoh penggunaan konversi mol ke volume:
Jika kita memiliki 2 mol gas hidrogen (H2), berapa volume gas hidrogen dalam liter?
Jawab:
Volume gas hidrogen dalam liter dapat dihitung dengan menggunakan konversi mol ke volume:
Volume = 2 mol x 22,4 liter/mol = 44,8 liter
Contoh Soal Konversi Mol ke Volume
Contoh soal yang akan kita bahas dalam bagian ini adalah sebagai berikut:
1. Berapa volume dalam liter dari 3 mol gas nitrogen (N2)?
Jawab:
Volume gas nitrogen dalam liter dapat dihitung dengan menggunakan konversi mol ke volume:
Volume = 3 mol x 22,4 liter/mol = 67,2 liter
2. Berapa volume dalam liter dari 0,5 mol gas oksigen (O2)?Jawab:Volume gas oksigen dalam liter dapat dihitung dengan menggunakan konversi mol ke volume:
Volume = 0,5 mol x 22,4 liter/mol = 11,2 liter
Hubungan antara Mol dan Stoikiometri
Definisi Stoikiometri
Stoikiometri adalah cabang kimia yang mempelajari hubungan antara jumlah partikel yang terlibat dalam suatu reaksi kimia. Konsep mol berperan penting dalam perhitungan stoikiometri, karena memungkinkan kita untuk menghubungkan antara jumlah partikel dengan massa atau volume suatu zat.
Penggunaan Konsep Mol dalam Perhitungan Stoikiometri
Dalam perhitungan stoikiometri, konsep mol digunakan untuk menentukan perbandingan antara jumlah partikel yang terlibat dalam reaksi kimia. Dengan menggunakan koefisien reaksi yang terdapat dalam persamaan reaksi, kita dapat menghitung jumlah mol suatu zat yang diperlukan atau dihasilkan dalam reaksi tersebut.
Contoh Soal Hubungan antara Mol dan Stoikiometri
Contoh soal yang akan kita bahas dalam bagian ini adalah sebagai berikut:
1. Dalam reaksi pembakaran etanol (C2H5OH), 2 mol etanol bereaksi dengan 6 mol oksigen (O2) untuk menghasilkan 4 mol karbon dioksida (CO2) dan 6 mol air (H2O). Jika kita memiliki 3 mol etanol, berapa mol karbon dioksida yang dihasilkan?
Jawab:
Pada persamaan reaksi, kita dapat melihat bahwa rasio mol etanol dengan mol karbon dioksida adalah 2:4 atau 1:2. Dengan demikian, jika kita memiliki 3 mol etanol, maka jumlah mol karbon dioksida yang dihasilkan adalah:
3 mol etanol x (2 mol CO2 / 2 mol etanol) = 3 mol CO2
2. Dalam reaksi pembentukan air (H2O), 4 mol hidrogen (H2) bereaksi dengan 2 mol oksigen (O2) untuk menghasilkan 4 mol air. Jika kita memiliki 5 mol oksigen, berapa mol hidrogen yang diperlukan?
Jawab:
Pada persamaan reaksi, kita dapat melihat bahwa rasio mol oksigen dengan mol hidrogen adalah 2:4 atau 1:2. Dengan demikian, jika kita memiliki 5 mol oksigen, maka jumlah mol hidrogen yang diperlukan adalah:
5 mol oksigen x (2 mol H2 / 2 mol O2) = 5 mol H2
Contoh Soal Konsep Mol
Contoh Soal Konsep Mol dan Jawabannya
Berikut ini beberapa contoh soal konsep mol dan jawabannya:
1. Berapa jumlah molekul dalam 0,5 mol glukosa (C6H12O6)?
Jawab:
Untuk menghitung jumlah molekul, kita dapat menggunakan konstanta Avogadro. Satu mol glukosa mengandung 6,022 x 10^23 molekul. Jadi, jumlah molekul dalam 0,5 mol glukosa adalah:
0,5 mol x 6,022 x 10^23 molekul/mol = 3,011 x 10^23 molekul
2. Berapa massa dalam gram dari 2 mol asam sulfat (H2SO4)?
Jawab:
Untuk menghitung massa, kita perlu menggunakan massa molar asam sulfat. Massa molar asam sulfat adalah 98 gram/mol. Jadi, massa dalam gram dari 2 mol asam sulfat adalah:
2 mol x 98 gram/mol = 196 gram
Aplikasi Konsep Mol dalam Kehidupan Sehari-hari
Aplikasi Konsep Mol dalam Industri Farmasi
Konsep mol memiliki aplikasi yang luas dalam industri farmasi. Dalam industri ini, konsep mol digunakan untuk menghitung jumlah bahan aktif dalam suatu obat. Dengan mengetahui jumlah mol bahan aktif, produsen obat dapat mengatur dosis yang tepat untuk pasien.
Aplikasi Konsep Mol dalam Industri Makanan
Di industri makanan, konsep mol digunakan untuk menghitung jumlah zat-zat yang terkandung dalam suatu produk makanan. Misalnya, dengan menggunakan konsep mol, produsen dapat menghitung jumlah gula, protein, atau lemak dalam suatu produk makanan.
Aplikasi Konsep Mol dalam Industri Kimia
Industri kimia juga banyak menggunakan konsep mol dalam berbagai proses produksi. Contohnya, konsep mol digunakan untuk mengukur jumlah bahan baku yang dibutuhkan dalam sintesis kimia, menghitung jumlah partikel dalam larutan, atau mengukur konsentrasi suatu zat dalam larutan.
Mol dalam Reaksi Redoks
Peran Konsep Mol dalam Reaksi Redoks
Reaksi redoks melibatkan perubahan dalam jumlah partikel, seperti elektron. Konsep mol memainkan peran penting dalam reaksi redoks karena memungkinkan kita untuk menghitung jumlah partikel yang terlibat dalam reaksi, seperti jumlah elektron yang dipindahkan atau jumlah molekul yang terlibat.
Contoh Soal Mol dalam Reaksi Redoks
Contoh soal yang akan kita bahas dalam bagian ini adalah sebagai berikut:
1. Dalam reaksi reduksi besi (Fe), 2 mol besi (Fe) mengalami oksidasi untuk membentuk 3 mol ion besi (Fe3+). Berapa jumlah elektron yang dipindahkan dalam reaksi ini?
Jawab:
Pada reaksi ini, setiap atom besi (Fe) kehilangan 3 elektron untuk membentuk ion besi (Fe3+). Jadi, jika kita memiliki 2 mol besi (Fe), maka jumlah elektron yang dipindahkan adalah:
2 mol x 6,022 x 10^23 atom/mol x 3 elektron/atom = 3,6132 x 10^24 elektron
2. Dalam reaksi oksidasi kalium (K), 1 mol kalium (K) mengalami oksidasi untuk membentuk 1 mol ion kalium positif (K+). Berapa jumlah elektron yang dipindahkan dalam reaksi ini?
Jawab:
Pada reaksi ini, setiap atom kalium (K) kehilangan 1 elektron untuk membentuk ion kalium positif (K+). Jadi, jika kita memiliki 1 mol kalium (K), maka jumlah elektron yang dipindahkan adalah:
1 mol x 6,022 x 10^23 atom/mol x 1 elektron/atom = 6,022 x 10^23 elektron
Konsep Mol dalam Elektrokimia
Penggunaan Konsep Mol dalam Perhitungan Elektrokimia
Elektrokimia adalah cabang kimia yang mempelajari hubungan antara reaksi kimia dan arus listrik. Konsep mol digunakan dalam perhitungan elektrokimia untuk menghubungkan antara jumlah partikel yang terlibat dalam reaksi dengan arus listrik yang dihasilkan.
Contoh Soal Konsep Mol dalam Elektrokimia
Contoh soal yang akan kita bahas dalam bagian ini adalah sebagai berikut:
1. Dalam sel elektrokimia yang menggunakan elektroda tembaga (Cu) dan seng (Zn), 2 mol ion tembaga positif (Cu2+) diperoleh melalui oksidasi 1 mol atom seng (Zn). Berapa jumlah arus listrik yang dihasilkan dalam reaksi ini?
Jawab:
Pada reaksiini, setiap atom seng (Zn) kehilangan 2 elektron untuk membentuk ion seng positif (Zn2+). Jadi, jika kita memiliki 1 mol atom seng (Zn), maka jumlah elektron yang dipindahkan adalah:
1 mol x 6,022 x 10^23 atom/mol x 2 elektron/atom = 1,2044 x 10^24 elektron
Dalam sel elektrokimia, setiap elektron yang dipindahkan setara dengan 1 coulomb arus listrik. Jadi, jumlah arus listrik yang dihasilkan dalam reaksi ini adalah:
1,2044 x 10^24 elektron x 1 coulomb/6,242 x 10^18 elektron = 192,9 coulomb
Kesimpulan
Secara keseluruhan, konsep mol adalah salah satu teori dasar dalam kimia yang penting untuk dipahami. Dalam artikel ini, kita telah menjelajahi konsep mol secara mendalam dan memberikan jawaban terperinci untuk berbagai pertanyaan seputar hal ini. Dalam pengenalan konsep mol, kita mempelajari apa itu mol, mengapa konsep mol penting, dan cara menghitung jumlah partikel dalam satu mol suatu zat. Selanjutnya, kita juga menjelaskan rumus mol untuk menghitung jumlah partikel, konversi mol ke gram dan volume, serta hubungan antara mol dan stoikiometri. Kemudian, kita melihat aplikasi konsep mol dalam industri farmasi, industri makanan, dan industri kimia. Selain itu, kita juga membahas peran konsep mol dalam reaksi redoks dan elektrokimia.
Dengan pemahaman yang baik tentang konsep mol, Anda akan lebih siap dalam memahami berbagai aspek kimia dan menerapkannya dalam kehidupan sehari-hari. Konsep mol membantu kita dalam menghitung jumlah partikel, menghubungkan antara massa atau volume dengan jumlah partikel, dan memahami reaksi kimia serta arus listrik yang terlibat. Teruslah belajar dan menjelajahi konsep mol ini untuk meningkatkan pemahaman Anda dalam dunia kimia.
