Sistem termokimia adalah bidang ilmu yang mempelajari interaksi antara energi termal dan reaksi kimia. Dalam artikel ini, kami akan menyajikan panduan komprehensif tentang sistem termokimia, termasuk konsep dasar, prinsip termodinamika yang terkait, serta aplikasi di berbagai bidang ilmu.
Pengenalan Sistem Termokimia
Definisi Sistem Termokimia
Sistem termokimia merupakan cabang ilmu yang mempelajari perubahan energi dalam reaksi kimia. Sistem ini melibatkan interaksi antara energi termal dan reaksi kimia yang terjadi. Dalam sistem termokimia, perubahan energi dalam suatu reaksi kimia dapat diukur dan dianalisis menggunakan prinsip-prinsip termodinamika.Tipe-Tipe Sistem Termokimia
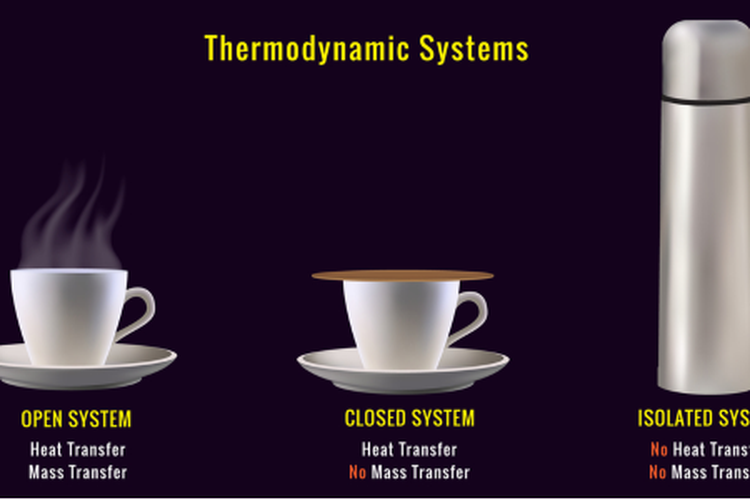
Dalam sistem termokimia, terdapat tiga tipe sistem yaitu sistem terbuka, sistem tertutup, dan sistem isolasi. Sistem terbuka adalah sistem yang dapat bertukar energi dan materi dengan lingkungan sekitarnya. Sistem tertutup adalah sistem yang hanya dapat bertukar energi dengan lingkungan, namun tidak dapat bertukar materi. Sementara itu, sistem isolasi adalah sistem yang tidak dapat bertukar energi maupun materi dengan lingkungan eksternalnya.Hukum-Hukum Termodinamika
Hukum-hukum termodinamika merupakan dasar dari sistem termokimia. Hukum pertama termodinamika menyatakan bahwa energi tidak dapat diciptakan atau dimusnahkan, namun hanya dapat diubah bentuknya. Hukum kedua termodinamika menyatakan bahwa entropi selalu meningkat atau tetap konstan dalam sistem yang terisolasi. Hukum ketiga termodinamika menyatakan bahwa suhu mutlak tidak dapat dicapai.Energi dalam Reaksi Kimia
Konsep Entalpi
Entalpi merupakan ukuran energi yang terkandung dalam suatu sistem. Dalam reaksi kimia, perubahan entalpi menyatakan perubahan energi yang terjadi saat reaksi berlangsung. Perubahan entalpi dapat bersifat eksotermik (melepaskan energi) atau endotermik (membutuhkan energi).Perubahan Entalpi dalam Reaksi Kimia
Perubahan entalpi dalam reaksi kimia dapat dihitung menggunakan persamaan termodinamika. Perubahan entalpi standar pembentukan adalah perubahan entalpi saat satu mol senyawa terbentuk dari unsur-unsur murni dengan keadaan standar. Perubahan entalpi reaksi adalah perubahan entalpi saat suatu reaksi kimia terjadi pada keadaan standar.Persamaan Termodinamika
Persamaan termodinamika digunakan untuk menghitung perubahan entalpi dalam reaksi kimia. Persamaan umumnya adalah ΔH = ΣΔHf (produk) - ΣΔHf (reaktan), di mana ΔH adalah perubahan entalpi, dan ΔHf adalah perubahan entalpi standar pembentukan.Entropi dan Energi Bebas Gibbs
Entropi adalah ukuran ketidakteraturan atau kerandoman suatu sistem. Perubahan entropi dalam reaksi kimia dapat mempengaruhi kemungkinan terjadinya reaksi tersebut. Energi bebas Gibbs adalah ukuran keseimbangan antara perubahan entalpi dan perubahan entropi dalam suatu sistem.Perubahan Entalpi
Pengertian Entalpi Standar Pembentukan
Entalpi standar pembentukan adalah perubahan entalpi yang terjadi saat satu mol senyawa terbentuk dari unsur-unsur murni pada keadaan standar. Keadaan standar adalah keadaan di mana tekanan adalah 1 atm, suhu adalah 298 K, dan zat-zat dalam keadaan fase stabil pada suhu tersebut.Pengertian Entalpi Reaksi
Entalpi reaksi adalah perubahan entalpi yang terjadi saat suatu reaksi kimia terjadi pada keadaan standar. Perubahan entalpi reaksi dapat dihitung dengan mengurangi jumlah entalpi produk dengan jumlah entalpi reaktan.Hukum Hess
Hukum Hess menyatakan bahwa perubahan entalpi dalam suatu reaksi kimia hanya bergantung pada keadaan awal dan keadaan akhir reaksi tersebut, dan tidak tergantung pada rute reaksi yang digunakan. Hukum Hess memungkinkan kita untuk menghitung perubahan entalpi suatu reaksi dengan menggunakan perubahan entalpi reaksi yang diketahui.Penerapan Hukum Hess dalam Menghitung Perubahan Entalpi
Dalam menghitung perubahan entalpi suatu reaksi, kita dapat menggunakan hukum Hess. Langkah-langkahnya adalah:1. Tentukan reaksi-reaksi antara senyawa-senyawa yang terlibat dalam reaksi yang ingin dihitung perubahan entalpinya.2. Sesuaikan koefisien stoikiometri sehingga jumlah mol reaktan dan produk sama dengan reaksi yang ingin dihitung.3. Jumlahkan perubahan entalpi reaksi yang diketahui untuk mendapatkan perubahan entalpi total.Contoh Perhitungan Perubahan Entalpi Menggunakan Hukum Hess
Misalkan kita ingin menghitung perubahan entalpi reaksi pembentukan air (H2O) dari hidrogen (H2) dan oksigen (O2). Kita dapat menggunakan perubahan entalpi reaksi pembentukan air dan perubahan entalpi reaksi pembakaran hidrogen dan oksigen untuk menghitung perubahan entalpi total. Dengan menggunakan hukum Hess, kita dapat menjumlahkan perubahan entalpi reaksi tersebut untuk mendapatkan perubahan entalpi reaksi pembentukan air.Hukum Termodinamika Pertama
Pengertian Hukum Termodinamika Pertama
Hukum termodinamika pertama menyatakan bahwa energi tidak dapat diciptakan atau dimusnahkan, namun hanya dapat diubah bentuknya. Dalam konteks sistem termokimia, hukum ini menyatakan bahwa energi total dalam suatu sistem tetap konstan, meskipun energi dapat berubah bentuk dari energi kinetik menjadi energi potensial atau sebaliknya.Energi dalam Sistem
Energi dalam sistem termokimia dapat berupa energi kinetik (energi gerak partikel) dan energi potensial (energi yang terkait dengan posisi partikel dalam sistem). Energi dalam sistem juga dapat berubah bentuk menjadi energi termal (energi panas) saat terjadi reaksi kimia atau perubahan suhu dalam sistem.Energi yang Keluar-Masuk dalam Sistem
Dalam sistem termokimia, energi dapat keluar atau masuk dalam bentuk panas (q) atau kerja (w). Panas adalah energi yang ditransfer karena perbedaan suhu antara sistem dan lingkungan, sedangkan kerja adalah energi yang ditransfer karena perubahan volume sistem. Perubahan energi dalam sistem dapat dihitung menggunakan persamaan ΔE = q + w, di mana ΔE adalah perubahan energi dalam sistem.Penerapan Hukum Termodinamika Pertama dalam Sistem Termokimia
Hukum termodinamika pertama dapat diterapkan dalam sistem termokimia untuk menghitung perubahan energi dalam suatu reaksi kimia. Dalam reaksi eksotermik, energi dilepaskan dari sistem ke lingkungan sehingga nilai q dalam persamaan ΔE = q + w adalah negatif. Sementara itu,dalam reaksi endotermik, energi diserap oleh sistem dari lingkungan sehingga nilai q dalam persamaan ΔE = q + w adalah positif. Dengan menggunakan hukum termodinamika pertama, kita dapat menghitung perubahan energi dalam sistem dan memahami bagaimana energi berpindah dalam suatu reaksi kimia.Contoh Penerapan Hukum Termodinamika Pertama
Misalkan kita memiliki reaksi pembakaran etanol (C2H5OH) yang eksotermik. Dalam reaksi ini, etanol bereaksi dengan oksigen untuk menghasilkan karbon dioksida (CO2) dan air (H2O). Dalam proses ini, energi dilepaskan dalam bentuk panas. Dengan menggunakan hukum termodinamika pertama, kita dapat menghitung perubahan energi dalam sistem berdasarkan perubahan suhu yang terjadi.Hukum Termodinamika Kedua
Pengertian Hukum Termodinamika Kedua
Hukum termodinamika kedua menyatakan bahwa entropi suatu sistem selalu meningkat atau tetap konstan dalam sistem yang terisolasi. Entropi adalah ukuran ketidakteraturan atau kerandoman suatu sistem. Hukum ini menyatakan bahwa dalam suatu proses spontan, entropi total sistem dan lingkungan akan meningkat atau tetap konstan.Konsep Entropi
Entropi dapat dianggap sebagai ukuran tingkat ketidakteraturan atau kerandoman suatu sistem. Semakin tinggi entropi suatu sistem, semakin tidak teratur sistem tersebut. Entropi dipengaruhi oleh faktor-faktor seperti jumlah partikel, keadaan agregasi partikel, dan suhu.Perubahan Entropi dalam Reaksi Kimia
Dalam reaksi kimia, perubahan entropi dapat terjadi akibat perubahan jumlah partikel, perubahan keadaan agregasi partikel, atau perubahan suhu. Perubahan entropi dapat dibedakan menjadi perubahan entropi positif (entropi meningkat) dan perubahan entropi negatif (entropi berkurang).Penerapan Hukum Termodinamika Kedua dalam Sistem Termokimia
Hukum termodinamika kedua dapat diterapkan dalam sistem termokimia untuk memahami arah reaksi dan keseimbangan termokimia. Dengan mempertimbangkan perubahan entropi dalam suatu reaksi, kita dapat memprediksi apakah reaksi tersebut akan terjadi spontan atau tidak. Reaksi yang memiliki perubahan entropi positif cenderung terjadi spontan, sedangkan reaksi dengan perubahan entropi negatif memerlukan energi tambahan untuk terjadi.Contoh Penerapan Hukum Termodinamika Kedua
Misalkan kita memiliki reaksi pengembunan gas CO2 di dalam sebuah wadah tertutup. Pada awalnya, gas CO2 berada dalam keadaan padat di dalam wadah. Ketika suhu dinaikkan, gas CO2 akan mengembang menjadi gas yang lebih terdispersi. Proses ini mengikuti hukum termodinamika kedua karena entropi sistem meningkat akibat perubahan keadaan agregasi partikel gas CO2. Dalam hal ini, reaksi pengembunan gas CO2 akan terjadi spontan karena entropi sistem meningkat.Energi Bebas Gibbs
Pengertian Energi Bebas Gibbs
Energi bebas Gibbs adalah ukuran keseimbangan antara perubahan entalpi dan perubahan entropi dalam suatu sistem termokimia. Energi bebas Gibbs (G) adalah energi yang tersedia untuk melakukan kerja selama suatu proses kimia pada tekanan dan suhu konstan.Kondisi Kesetimbangan
Dalam sistem termokimia, kondisi kesetimbangan dapat ditentukan dengan menggunakan energi bebas Gibbs. Pada kondisi kesetimbangan, energi bebas Gibbs sistem mencapai nilai minimum atau maksimum tergantung pada apakah reaksi bersifat eksotermik atau endotermik.Perubahan Energi Bebas Gibbs dalam Reaksi Kimia
Perubahan energi bebas Gibbs (ΔG) dalam reaksi kimia dapat digunakan untuk memprediksi arah reaksi dan kecenderungan suatu reaksi untuk mencapai kesetimbangan. Jika ΔG negatif, reaksi cenderung terjadi spontan dan bergerak menuju kesetimbangan. Sebaliknya, jika ΔG positif, reaksi tidak akan terjadi spontan dan memerlukan energi tambahan untuk terjadi.Persamaan Energi Bebas Gibbs
Energi bebas Gibbs (G) dapat dihitung menggunakan persamaan G = H - TS, di mana G adalah energi bebas Gibbs, H adalah entalpi, T adalah suhu dalam Kelvin, dan S adalah entropi. Dalam persamaan ini, perubahan energi bebas Gibbs (ΔG) dapat dihitung menggunakan persamaan ΔG = ΔH - TΔS.Aplikasi Sistem Termokimia dalam Industri
Pembuatan Baja
Sistem termokimia digunakan dalam industri baja untuk mengoptimalkan proses pembuatan baja. Dalam proses ini, reaksi kimia seperti oksidasi dan reduksi terjadi pada suhu tinggi untuk mengubah bijih besi menjadi baja. Sistem termokimia digunakan untuk mengontrol suhu dan energi dalam reaksi, sehingga menghasilkan baja dengan kualitas yang diinginkan.Produksi Amonia
Amonia (NH3) adalah bahan kimia penting dalam industri pupuk. Sistem termokimia digunakan dalam proses produksi amonia untuk mengoptimalkan reaksi antara nitrogen dan hidrogen. Melalui pemantauan suhu dan energi dalam sistem, efisiensi reaksi dapat ditingkatkan dan produksi amonia dapat dioptimalkan.Pengolahan Minyak Bumi
Sistem termokimia juga digunakan dalam industri pengolahan minyak bumi. Dalam proses ini, minyak bumi diolah melalui reaksi kimia kompleks untuk menghasilkan berbagai produk seperti bensin, diesel, dan bahan bakar jet. Sistem termokimia digunakan untuk mengontrol suhu dan energi dalam reaksi, sehingga menghasilkan produk dengan kualitas dan rendemen yang optimal.Aplikasi Sistem Termokimia dalam Kehidupan Sehari-hari
Proses Memasak
Dalam memasak, sistem termokimia digunakan untuk mengoptimalkan reaksi kimia yang terjadi saat memasak makanan. Misalnya, saat memasak nasi, panas yang diaplikasikan pada beras menghasilkan perubahan kimia sehingga beras menjadi matang dan empuk. Dalam proses ini, sistem termokimia membantu mengontrol suhu dan energi yang diperlukan untuk memasak dengan baik.Pendinginan dan Pemanasan Rumah
Dalam sistem pemanasan dan pendinginan rumah, sistem termokimia digunakan untuk mengoptimalkan penggunaan energi dalam proses pemanasan dan pendinginan. Misalnya, dalam sistem pemanasan, sistem termokimia digunakan untuk menghasilkan panas melalui reaksi kimia sehingga suhu dalam rumah dapat diatur sesuai kebutuhan. Dalam sistem pendinginan, sistem termokimia digunakan untuk mengoptimalkan penggunaan energi dalam proses pengkondisian udara sehingga suhu dalam rumah dapat dijaga pada tingkat yang nyaman.Pembangkitan Energi Listrik
Sistem termokimia juga digunakan dalam pembangkitan energi listrik. Dalam pembangkitan energi listrik dengan menggunakan pembangkit listrik tenaga uap, sistem termokimia digunakan untuk menghasilkan uap yang akan digunakan untuk menggerakkan turbin. Melalui reaksikimia antara bahan bakar dan oksigen, energi termal diubah menjadi energi mekanik yang kemudian digunakan untuk menghasilkan energi listrik.Konsep Entropi dalam Kehidupan Sehari-hari
Entropi juga dapat diamati dalam kehidupan sehari-hari. Misalnya, saat kita menyortir pakaian kotor dan mencucinya, entropi meningkat karena pakaian yang awalnya teratur menjadi tercampur dan tidak teratur dalam mesin cuci. Begitu juga saat kita membersihkan rumah, ketika kita mengacak-acak barang-barang dan menata ulang, entropi meningkat karena keadaan tidak teratur menjadi lebih teratur.Penerapan Sistem Termokimia dalam Reaksi Redoks
Sistem termokimia juga berperan penting dalam reaksi redoks, di mana terjadi perubahan oksidasi dan reduksi. Dalam reaksi ini, perubahan entalpi dan energi bebas Gibbs digunakan untuk memprediksi arah reaksi dan kecenderungan suatu zat untuk menerima atau melepaskan elektron.Contoh Penerapan Sistem Termokimia dalam Reaksi Redoks
Misalnya, dalam reaksi elektrolisis, energi listrik digunakan untuk memisahkan senyawa menjadi elemen-elemennya melalui reaksi redoks. Dalam proses ini, sistem termokimia digunakan untuk menghitung perubahan entalpi dan energi bebas Gibbs yang terjadi selama reaksi elektrolisis.Tantangan dan Perkembangan Terkini dalam Sistem Termokimia
Sistem termokimia terus menghadapi tantangan dan mengalami perkembangan terkini. Salah satu tantangan utama adalah efisiensi energi dalam reaksi kimia. Penelitian terus dilakukan untuk mengoptimalkan penggunaan energi dalam sistem termokimia dan meningkatkan efisiensi reaksi kimia.Perkembangan terkini dalam sistem termokimia juga melibatkan pemanfaatan teknologi yang lebih canggih, seperti penggunaan katalis yang efisien dan pengembangan reaktor yang lebih efektif. Selain itu, penelitian juga dilakukan untuk memahami lebih dalam tentang peran entropi dalam sistem termokimia dan bagaimana mengoptimalkan penggunaannya.
Dalam kesimpulan, sistem termokimia merupakan bidang ilmu yang penting dan memiliki aplikasi yang luas dalam berbagai aspek kehidupan. Dengan pemahaman yang mendalam tentang konsep dan prinsip-prinsip termodinamika yang terkait, kita dapat meningkatkan efisiensi reaksi kimia, mengoptimalkan penggunaan energi, dan menjaga keseimbangan energi dalam sistem. Semoga artikel ini memberikan wawasan yang komprehensif tentang sistem termokimia dan manfaatnya bagi dunia ilmu pengetahuan dan industri.
