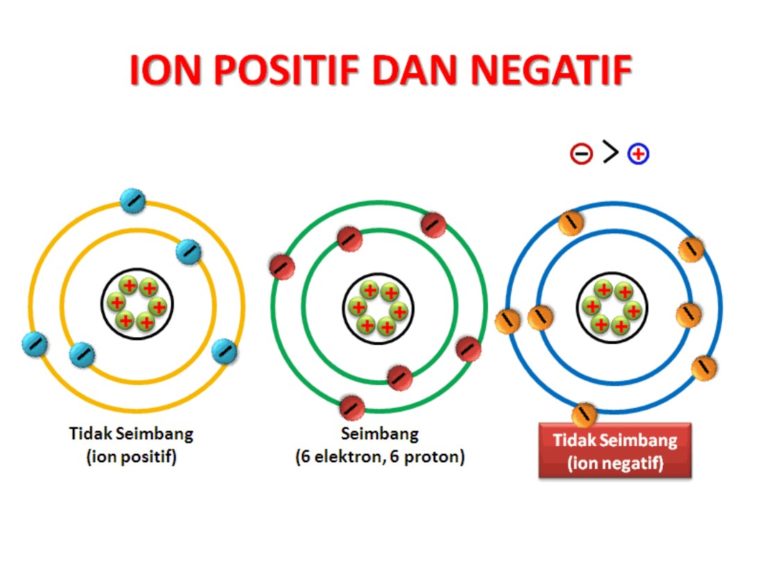
Ikatan ionik merupakan salah satu jenis ikatan kimia yang terbentuk antara atom dengan muatan listrik yang berbeda. Ikatan ini terjadi ketika atom dengan keelektronegatifan yang berbeda bertemu dan berinteraksi. Atom dengan keelektronegatifan rendah, seperti logam, cenderung kehilangan elektron sehingga membentuk ion positif (kation). Sedangkan atom dengan keelektronegatifan tinggi, seperti non-logam, cenderung menerima elektron sehingga membentuk ion negatif (anion). Kation dan anion saling tertarik satu sama lain melalui gaya elektrostatik, membentuk struktur kristal padat yang stabil. Dalam artikel ini, kita akan menjelajahi secara mendalam tentang sifat ikatan ionik, termasuk konsep dasarnya, contoh-contoh yang relevan, dan karakteristik uniknya.
Konsep Dasar Ikatan Ionik
Ikatan ionik terbentuk melalui interaksi elektrostatik antara ion-ion yang terbentuk oleh atom dengan muatan listrik yang berbeda. Atom dengan keelektronegatifan rendah cenderung melepaskan satu atau lebih elektron dari kulit terluarnya, sehingga membentuk kation. Sedangkan atom dengan keelektronegatifan tinggi cenderung menerima elektron tersebut, sehingga membentuk anion. Kation dan anion saling tertarik oleh gaya elektrostatik yang kuat, membentuk ikatan ionik. Konsep ini merupakan dasar dari sifat ikatan ionik yang unik.
Contoh ikatan ionik yang paling umum adalah ikatan antara logam natrium (Na) dan non-logam klorin (Cl) dalam senyawa natrium klorida (NaCl). Atom natrium secara spontan kehilangan satu elektron untuk membentuk kation Na+, sedangkan atom klorin menerima elektron tersebut untuk membentuk anion Cl-. Kation Na+ dan anion Cl- saling tertarik satu sama lain, membentuk kristal padat berbentuk kubus yang dikenal sebagai garam dapur. Ikatan ionik juga terbentuk antara berbagai logam dan non-logam lainnya, seperti ikatan antara logam magnesium (Mg) dan non-logam oksigen (O) dalam senyawa magnesium oksida (MgO).
Struktur Kristal Padat
Sifat ikatan ionik yang mencolok adalah terbentuknya struktur kristal padat yang stabil. Dalam struktur kristal padat, ion-ion kation dan anion tersusun secara teratur dalam susunan tiga dimensi yang berulang. Susunan ini memungkinkan terbentuknya jarak tetap antara ion-ion yang saling tertarik. Misalnya, dalam senyawa natrium klorida (NaCl), ion natrium (Na+) dan ion klorin (Cl-) tersusun secara bergantian membentuk kristal padat berbentuk kubus. Struktur kristal ini memberikan kekuatan pada senyawa ionik, sehingga senyawa tersebut umumnya keras dan rapat.
Kekuatan Ikatan
Ikatan ionik memiliki kekuatan yang tinggi karena gaya elektrostatik yang kuat antara ion-ion kation dan anion. Gaya elektrostatik ini bekerja pada jarak tertentu, sehingga ikatan ionik membutuhkan energi yang signifikan untuk diputuskan. Titik leleh dan titik didih senyawa ionik umumnya tinggi, karena energi yang diperlukan untuk memisahkan ion-ion tersebut. Sebagai contoh, senyawa natrium klorida (NaCl) memiliki titik leleh sekitar 801°C dan titik didih sekitar 1413°C. Kekuatan ikatan ionik yang tinggi juga menjelaskan mengapa senyawa ionik biasanya berada dalam keadaan padat pada suhu kamar.
Karakteristik Ikatan Ionik
Ikatan ionik memiliki beberapa karakteristik yang membedakannya dari ikatan kimia lainnya. Karakteristik ini meliputi keadaan agregat, kekerasan dan kerapatan, titik leleh dan titik didih, konduktivitas listrik, dan kelarutan dalam air.
Keadaan Agregat
Senyawa ionik umumnya berada dalam keadaan padat pada suhu kamar. Hal ini disebabkan oleh kekuatan ikatan ionik yang kuat antara ion-ion kation dan anion. Ikatan ionik membutuhkan energi yang signifikan untuk memisahkan ion-ion tersebut, sehingga senyawa ionik umumnya berada dalam bentuk padat yang teratur. Contohnya, natrium klorida (NaCl) berada dalam bentuk kristal padat, sedangkan natrium klorida cair hanya terbentuk pada suhu yang sangat tinggi.
Kekerasan dan Kerapatan
Senyawa ionik umumnya keras dan memiliki kerapatan yang tinggi. Keadaan padat pada senyawa ionik disebabkan oleh struktur kristal yang terbentuk oleh ion-ion kation dan anion yang tersusun secara teratur. Struktur ini memberikan kekuatan pada senyawa ionik, sehingga senyawa tersebut biasanya keras dan rapat. Sebagai contoh, garam dapur (NaCl) memiliki kekerasan tinggi dan kerapatan sekitar 2,17 g/cm³. Keadaan keras dan rapat ini juga menjelaskan mengapa senyawa ionik umumnya memiliki titik leleh dan titik didih yang tinggi.
Titik Leleh dan Titik Didih
Senyawa ionik memiliki titik leleh dan titik didih yang tinggi. Hal ini disebabkan oleh kekuatan ikatan ionik yang tinggi antara ion-ion kation dan anion. Titik leleh dan titik didih senyawa ionik merupakan suhu di mana ikatan ionik terputus, sehingga senyawa tersebut berubah dari keadaan padat menjadi cair atau gas. Misalnya, natrium klorida (NaCl) memiliki titik leleh sekitar 801°C dan titik didih sekitar 1413°C. Titik leleh dan titik didih yang tinggi ini mengindikasikan kestabilan struktur kristal pada senyawa ionik.
Konduktivitas Listrik
Senyawa ionik dapat menghantarkan listrik dalam larutan atau cairan, tetapi tidak dalam keadaan padat. Hal ini disebabkan oleh pergerakan ion-ion yang memungkinkan aliran arus listrik. Ketika senyawa ionik dilarutkan dalam air atau pelarut lainnya, ion-ionnya terdisosiasi dan menjadi bebas bergerak. Ion-ion yang bebas bergerak ini dapat membawa muatan listrik dan memungkankan aliran arus listrik dalam larutan. Namun, dalam keadaan padat, ion-ion tersebut terkunci dalam struktur kristal dan tidak dapat bergerak, sehingga senyawa ionik tidak dapat menghantarkan listrik.
Larut dalam Air
Banyak senyawa ionik larut dalam air karena ion-ionnya dapat berinteraksi dengan molekul air melalui gaya elektrostatik. Ketika senyawa ionik dilarutkan dalam air, ion-ionnya terdisosiasi dan dikelilingi oleh molekul air. Kation-kation dikelilingi oleh molekul air yang bermuatan negatif (uap), sedangkan anion-anion dikelilingi oleh molekul air yang bermuatan positif (δ-). Interaksi antara ion-ion dan molekul air ini memungkinkan senyawa ionik terlarut dalam air. Sebagai contoh, natrium klorida (NaCl) sangat larut dalam air karena ion Na+ dan Cl- dapat berinteraksi dengan molekul air melalui gaya elektrostatik.
Kesimpulan
Sifat ikatan ionik melibatkan interaksi elektrostatik antara ion-ion yang terbentuk oleh atom dengan muatan listrik yang berbeda. Konsep dasar, contoh-contohdan karakteristik unik dari ikatan ionik telah dijelaskan dalam artikel ini. Ikatan ionik terjadi ketika atom dengan keelektronegatifan yang berbeda bertemu dan berinteraksi, yang mengakibatkan atom kehilangan atau menerima elektron untuk membentuk ion kation dan anion. Kation dan anion saling tertarik satu sama lain melalui gaya elektrostatik yang kuat, membentuk struktur kristal padat yang stabil.
Konsep dasar ikatan ionik melibatkan pertukaran elektron antara atom dengan muatan listrik yang berbeda. Atom logam cenderung kehilangan satu atau lebih elektron dari kulit terluarnya, sehingga membentuk ion kation yang bermuatan positif. Sedangkan atom non-logam cenderung menerima elektron tersebut, membentuk ion anion yang bermuatan negatif. Kation dan anion saling tertarik oleh gaya elektrostatik yang kuat, membentuk ikatan ionik. Contoh paling umum dari ikatan ionik adalah ikatan antara logam natrium (Na) dan non-logam klorin (Cl) dalam senyawa natrium klorida (NaCl).
Struktur kristal padat yang terbentuk dalam senyawa ionik adalah salah satu karakteristik utama ikatan ionik. Dalam struktur kristal, ion-ion kation dan anion tersusun secara teratur dalam susunan tiga dimensi yang berulang. Susunan ini memungkinkan terbentuknya jarak tetap antara ion-ion yang saling tertarik. Misalnya, dalam senyawa natrium klorida (NaCl), ion natrium (Na+) dan ion klorin (Cl-) tersusun secara bergantian membentuk kristal padat berbentuk kubus. Struktur kristal inilah yang memberikan kekuatan pada senyawa ionik dan menjelaskan mengapa senyawa ini umumnya keras dan rapat.
Kekuatan ikatan ionik juga menjadi salah satu karakteristik penting dari ikatan ini. Gaya elektrostatik yang kuat antara ion-ion kation dan anion menghasilkan kekuatan ikatan yang tinggi. Ini berarti ikatan ionik membutuhkan energi yang signifikan untuk diputuskan. Titik leleh dan titik didih senyawa ionik umumnya tinggi, karena energi yang diperlukan untuk memisahkan ion-ion tersebut. Sebagai contoh, senyawa natrium klorida (NaCl) memiliki titik leleh sekitar 801°C dan titik didih sekitar 1413°C. Titik leleh dan titik didih yang tinggi ini mengindikasikan kestabilan struktur kristal pada senyawa ionik.
Selain itu, karakteristik ikatan ionik juga meliputi keadaan agregat, kekerasan dan kerapatan, konduktivitas listrik, dan kelarutan dalam air. Senyawa ionik umumnya berada dalam keadaan padat pada suhu kamar karena kekuatan ikatan yang kuat. Mereka juga cenderung keras dan memiliki kerapatan yang tinggi karena struktur kristal padat yang terbentuk oleh ion-ion kation dan anion. Namun, senyawa ionik dapat menghantarkan listrik dalam larutan atau cairan karena ion-ionnya dapat bergerak bebas. Kelarutan dalam air juga merupakan karakteristik umum dari senyawa ionik karena ion-ionnya dapat berinteraksi dengan molekul air melalui gaya elektrostatik.
Dalam kesimpulannya, sifat ikatan ionik melibatkan interaksi elektrostatik antara ion-ion yang terbentuk oleh atom dengan muatan listrik yang berbeda. Konsep dasar, contoh-contoh, dan karakteristik unik dari ikatan ionik telah dijelaskan dalam artikel ini. Memahami sifat ikatan ionik penting dalam mempelajari kimia dan aplikasinya dalam berbagai bidang ilmu pengetahuan dan teknologi. Ikatan ionik memiliki peran penting dalam membentuk senyawa ionik yang memiliki kekuatan, sifat fisik, dan sifat kimia yang khas.
