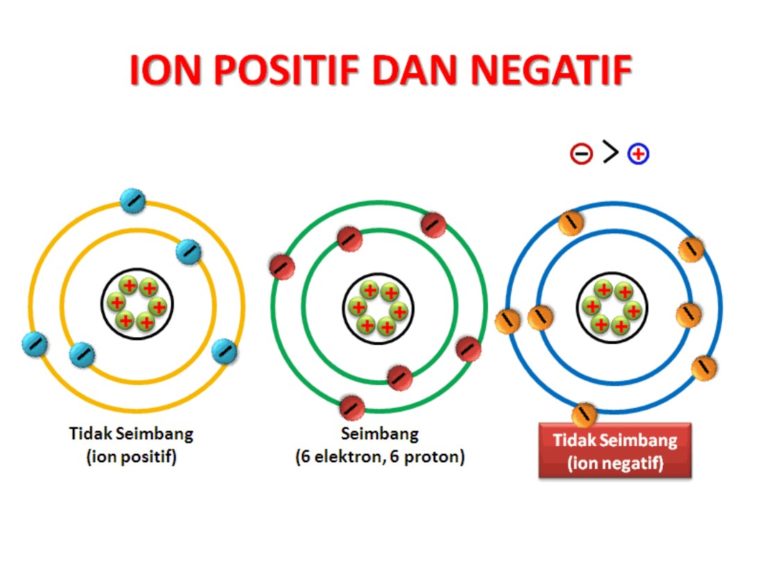
Pengertian ion dan contohnya merupakan topik yang sangat penting dalam bidang kimia. Dalam ilmu kimia, ion merujuk pada atom atau molekul yang memiliki muatan listrik. Muatan ini terjadi karena jumlah elektron dalam atom atau molekul tersebut tidak seimbang dengan jumlah protonnya. Dalam artikel ini, kita akan membahas secara rinci mengenai pengertian ion, jenis-jenis ion, serta contoh-contoh ion yang umum dijumpai dalam kehidupan sehari-hari.
Ion merupakan bagian penting dalam dunia kimia karena mereka memainkan peran kunci dalam berbagai reaksi kimia. Ion terbentuk melalui beberapa proses, salah satunya adalah dengan melepaskan atau menerima elektron. Ion yang kehilangan elektron akan memiliki muatan positif dan disebut dengan kation, sedangkan ion yang menerima elektron akan memiliki muatan negatif dan disebut dengan anion. Kation dan anion ini memiliki sifat dan perilaku yang berbeda dalam reaksi kimia.
Kation dan Anion
Kation merupakan ion dengan muatan positif yang terbentuk ketika atom kehilangan satu atau lebih elektron. Proses kehilangan elektron ini dapat terjadi ketika atom memiliki kecenderungan untuk melepaskan elektron demi mencapai konfigurasi elektron yang lebih stabil. Contoh kation yang umum dijumpai adalah ion natrium (Na+). Atom natrium memiliki satu elektron valensi yang mudah lepas, sehingga ketika atom ini kehilangan elektronnya, ia akan membentuk ion natrium yang memiliki muatan positif. Ion ini sering ditemukan dalam garam dapur dan berperan penting dalam keseimbangan elektrolit dalam tubuh manusia.
Anion, di sisi lain, merupakan ion dengan muatan negatif yang terbentuk ketika atom menerima satu atau lebih elektron. Proses penerimaan elektron ini terjadi ketika atom memiliki kecenderungan untuk menarik elektron demi mencapai konfigurasi elektron yang lebih stabil. Contoh anion yang umum dijumpai adalah ion klorida (Cl-). Atom klorin memiliki tujuh elektron valensi dan kecenderungan untuk menerima satu elektron lagi. Ketika atom klorin menerima satu elektron, ia akan membentuk ion klorida yang memiliki muatan negatif. Ion ini sering ditemukan dalam garam dapur dan juga berperan penting dalam menjaga keseimbangan elektrolit dalam tubuh manusia.
Kation dan Anion dalam Reaksi Kimia
Kation dan anion memiliki sifat dan perilaku yang berbeda dalam reaksi kimia. Kation cenderung bersifat asam, sedangkan anion cenderung bersifat basa. Hal ini karena kation memiliki kecenderungan untuk melepaskan proton (H+), sedangkan anion memiliki kecenderungan untuk menerima proton (H+). Oleh karena itu, dalam reaksi netralisasi antara kation dan anion, terbentuklah senyawa netral.
Contoh reaksi netralisasi antara kation dan anion adalah reaksi antara ion natrium (Na+) dan ion klorida (Cl-). Dalam reaksi ini, ion natrium kehilangan satu elektron untuk membentuk ion natrium yang bermuatan positif, sedangkan ion klorida menerima satu elektron untuk membentuk ion klorida yang bermuatan negatif. Ketika ion natrium dan ion klorida bertemu, terjadi reaksi netralisasi di antara keduanya, dan terbentuklah senyawa netral yaitu garam dapur (NaCl). Reaksi netralisasi ini banyak terjadi dalam kehidupan sehari-hari, seperti dalam proses memasak dan dalam sistem pencernaan manusia.
Ion Monoatomik dan Poliatomik
Ion dapat dibedakan menjadi dua jenis, yaitu ion monoatomik dan poliatomik. Ion monoatomik adalah ion yang terbentuk dari satu atom saja. Contoh ion monoatomik yang umum dijumpai adalah ion kalsium (Ca2+). Atom kalsium memiliki dua elektron valensi yang mudah lepas, sehingga ketika atom ini kehilangan dua elektron, ia akan membentuk ion kalsium yang memiliki muatan positif. Ion kalsium ini memiliki peran penting dalam menjaga keseimbangan elektrolit dalam tubuh manusia dan juga berperan dalam pembentukan tulang dan gigi.
Selain ion monoatomik, terdapat juga ion poliatomik yang terbentuk dari beberapa atom yang terikat bersama-sama. Contoh ion poliatomik yang umum dijumpai adalah ion nitrat (NO3-). Ion nitrat terbentuk dari atom nitrogen (N) yang terikat dengan tiga atom oksigen (O). Atom nitrogen dalam ion nitrat memiliki kecenderungan untuk menerima satu elektron, sehingga ion nitrat memiliki muatan negatif. Ion nitrat sering ditemukan dalam pupuk dan berperan penting dalam proses pertumbuhan tanaman.
Pola Pembentukan Ion Monoatomik dan Poliatomik
Pembentukan ion monoatomik dan poliatomik dipengaruhi oleh sifat dan kecenderungan atom-atom tersebut. Atom-atom dengan kecenderungan untuk melepaskan elektron akan membentuk kation, sedangkan atom-atom dengan kecenderungan untuk menerima elektron akan membentuk anion.
Pada atom-atom logam, elektron valensi cenderung mudah lepas sehingga atom-atom ini memiliki kecenderungan untuk membentuk kation. Contohnya adalah atom natrium (Na) yang memiliki satu elektron valensi yang mudah lepas. Ketika atom natrium kehilangan satu elektron, ia akan membentuk ion natrium (Na+) yang bermuatan positif. Ion natrium ini sangat reaktif dan sering terlibat dalam berbagai reaksi kimia.
Pada atom-atom nonlogam, elektron valensi cenderung untuk menarik elektron tambahan sehingga atom-atom ini memiliki kecenderungan untuk membentuk anion. Contohnya adalah atom klorin (Cl) yang memiliki tujuh elektron valensi dan kecenderungan untuk menerima satu elektron lagi. Ketika atom klorin menerima satu elektron, ia akan membentuk ion klorida (Cl-) yang bermuatan negatif. Ion klorida ini sering terdapat dalam garam dapur dan juga berperan dalam menjaga keseimbangan elektrolit dalam tubuh manusia.
Ion Logam dan Nonlogam
Ion dapat dibedakan menjadi dua kelompok, yaitu ion logam dan nonlogam. Ion logam terbentuk dari atom logam yang kehilangan satu atau lebih elektron. Contohnya adalah ion besi (Fe2+ dan Fe3+). Atom besi memiliki konfigurasi elektron yang mudah kehilangan dua atau tiga elektron, sehingga dapat membentuk ion besi yang bermuatan positif. Ion besi ini memiliki banyak peran dalam tubuh manusia, seperti dalam proses pembentukan hemoglobin dan sebagai katalisator dalam reaksi kimia.
Ion nonlogam, di sisi lain, terbentuk dari atom nonlogam yang menerima satu atau lebih elektron. Contohnya adalah ion klorida (Cl-). Atom klorin memiliki kecenderungan untuk menarik satu elektron tambahan, sehingga dapat membentuk ion klorida yang bermuatan negatif. Ion klorida ini sering terdapat dalam garam dapur dan berperan penting dalam menjaga keseimbangan elektrolit dalam tubuh manusia.
Sifat dan Perilaku Ion Logam dan Nonlogam
Ion logam dan nonlogam memiliki sifat dan perilaku yang berbeda dalam reaksi kimia. Ion logam cenderung bersifat asam dan memiliki kecenderungan untuk melepaskan proton (H+). Hal ini karena ion logam memiliki kecenderungan untuk melepaskan elektron valensi yang mudah lepas. Contohnya adalah ion aluminium (Al3+). Ion aluminium ini memiliki tiga elektron valensi yang mudah lepas, sehingga dapat melepaskan tiga proton dan membentuk ion aluminium yang bermuatan positif. Ion aluminium sering terdapat dalam larutan asam dan berperanpenting dalam industri pengolahan logam dan pembuatan kertas.
Sementara itu, ion nonlogam cenderung bersifat basa dan memiliki kecenderungan untuk menerima proton (H+). Hal ini karena atom nonlogam memiliki kecenderungan untuk menarik elektron tambahan untuk mencapai konfigurasi elektron yang lebih stabil. Contohnya adalah ion klorida (Cl-). Atom klorin memiliki tujuh elektron valensi dan kecenderungan untuk menerima satu elektron lagi. Ketika atom klorin menerima satu elektron, ia akan membentuk ion klorida yang bermuatan negatif. Ion klorida sering terdapat dalam larutan basa dan juga berperan penting dalam menjaga keseimbangan elektrolit dalam tubuh manusia.
Ion Monopositif dan Mononegatif
Ion dapat dibedakan menjadi dua kelompok lagi, yaitu ion monopositif dan mononegatif. Ion monopositif adalah ion dengan muatan positif 1+. Contohnya adalah ion kalium (K+). Atom kalium memiliki satu elektron valensi yang mudah lepas, sehingga ketika atom kalium kehilangan elektron tersebut, ia akan membentuk ion kalium yang bermuatan positif. Ion kalium ini sering ditemukan dalam larutan elektrolit dan berperan penting dalam menjaga fungsi otot dan sistem saraf dalam tubuh manusia.
Ion mononegatif, di sisi lain, adalah ion dengan muatan negatif 1-. Contohnya adalah ion klorida (Cl-). Atom klorin memiliki kecenderungan untuk menarik satu elektron tambahan, sehingga membentuk ion klorida yang bermuatan negatif. Ion klorida ini sering ditemukan dalam larutan elektrolit dan juga berperan penting dalam menjaga keseimbangan elektrolit dalam tubuh manusia.
Sifat dan Perilaku Ion Monopositif dan Mononegatif
Ion monopositif dan mononegatif memiliki sifat dan perilaku yang berbeda dalam reaksi kimia. Ion monopositif cenderung bersifat asam dan memiliki kecenderungan untuk melepaskan proton (H+). Hal ini karena ion monopositif memiliki kecenderungan untuk melepaskan satu elektron valensi yang mudah lepas. Contohnya adalah ion natrium (Na+). Atom natrium memiliki satu elektron valensi yang mudah lepas, sehingga ketika atom natrium kehilangan elektron tersebut, ia akan membentuk ion natrium yang bermuatan positif. Ion natrium ini sering terdapat dalam larutan asam dan berperan penting dalam menjaga keseimbangan air dan elektrolit dalam tubuh manusia.
Ion mononegatif, di sisi lain, cenderung bersifat basa dan memiliki kecenderungan untuk menerima proton (H+). Hal ini karena ion mononegatif memiliki kecenderungan untuk menarik elektron tambahan untuk mencapai konfigurasi elektron yang lebih stabil. Contohnya adalah ion klorida (Cl-). Atom klorin memiliki tujuh elektron valensi dan kecenderungan untuk menerima satu elektron lagi. Ketika atom klorin menerima elektron tambahan, ia akan membentuk ion klorida yang bermuatan negatif. Ion klorida ini sering terdapat dalam larutan basa dan juga berperan penting dalam menjaga keseimbangan elektrolit dalam tubuh manusia.
Ion Polipositif dan Polinegatif
Ion dapat memiliki muatan positif atau negatif lebih dari 1+. Ion dengan muatan positif lebih dari 1+ disebut ion polipositif, sedangkan ion dengan muatan negatif lebih dari 1- disebut ion polinegatif. Ion polipositif terbentuk ketika atom logam kehilangan beberapa elektron. Contohnya adalah ion kalsium (Ca2+) yang terbentuk ketika atom kalsium kehilangan dua elektron. Ion kalsium ini sering ditemukan dalam larutan elektrolit dan berperan penting dalam pembentukan tulang dan gigi, serta dalam kontraksi otot dan fungsi saraf.
Ion polinegatif terbentuk ketika atom nonlogam menerima beberapa elektron. Contohnya adalah ion oksida (O2-) yang terbentuk ketika atom oksigen menerima dua elektron. Ion oksida ini sering terdapat dalam larutan elektrolit dan juga berperan penting dalam proses pernapasan seluler dan pembentukan asam.
Sifat dan Perilaku Ion Polipositif dan Polinegatif
Ion polipositif cenderung bersifat asam dan memiliki kecenderungan untuk melepaskan proton (H+). Hal ini karena ion polipositif memiliki kecenderungan untuk melepaskan beberapa elektron valensi yang mudah lepas. Contohnya adalah ion kalsium (Ca2+). Atom kalsium memiliki dua elektron valensi yang mudah lepas, sehingga ketika atom kalsium kehilangan dua elektron tersebut, ia akan membentuk ion kalsium yang bermuatan positif. Ion kalsium ini sering terdapat dalam larutan asam dan berperan penting dalam menjaga keseimbangan elektrolit dalam tubuh manusia.
Ion polinegatif, di sisi lain, cenderung bersifat basa dan memiliki kecenderungan untuk menerima proton (H+). Hal ini karena ion polinegatif memiliki kecenderungan untuk menarik elektron tambahan untuk mencapai konfigurasi elektron yang lebih stabil. Contohnya adalah ion oksida (O2-). Atom oksigen memiliki kecenderungan untuk menarik dua elektron tambahan, sehingga membentuk ion oksida yang bermuatan negatif. Ion oksida ini sering terdapat dalam larutan basa dan juga berperan penting dalam menjaga keseimbangan elektrolit dalam tubuh manusia.
Ion Asam dan Ion Basa
Ion asam dan ion basa merupakan istilah yang sering digunakan dalam kimia. Ion asam adalah ion yang terbentuk ketika suatu molekul asam melepaskan satu atau lebih proton (H+). Proses pelepasan proton ini terjadi karena molekul asam memiliki kecenderungan untuk melepaskan proton demi mencapai kestabilan. Contohnya adalah ion hidrogen sulfat (HSO4-). Molekul asam sulfat (H2SO4) dapat melepaskan satu proton untuk membentuk ion hidrogen sulfat yang bermuatan negatif. Ion hidrogen sulfat ini sering terdapat dalam larutan asam kuat dan berperan penting dalam proses pengawetan makanan dan produksi pupuk.
Ion basa, di sisi lain, adalah ion yang terbentuk ketika suatu molekul basa menerima satu atau lebih proton (H+). Proses penerimaan proton ini terjadi karena molekul basa memiliki kecenderungan untuk menerima proton demi mencapai kestabilan. Contohnya adalah ion hidroksida (OH-). Molekul basa amonium (NH4OH) dapat menerima satu proton untuk membentuk ion hidroksida yang bermuatan negatif. Ion hidroksida ini sering terdapat dalam larutan basa kuat dan berperan penting dalam proses pengolahan air minum dan produksi sabun.
Sifat dan Perilaku Ion Asam dan Ion Basa
Ion asam cenderung bersifat asam dan memiliki kecenderungan untuk melepaskan proton (H+). Hal ini karena ion asam terbentuk dari molekul asam yang memiliki kecenderungan untuk melepaskan proton demi mencapai kestabilan. Contohnya adalah ion hidrogen sulfat (HSO4-). Molekul asam sulfat (H2SO4) dapat melepaskan satu proton untuk membentuk ion hidrogen sulfat yang bermuatan negatif. Ion hidrogen sulfat ini sering terdapat dalam larutan asam kuat dan berperan penting dalam proses pengawetan makanan dan produksi pupuk.
Ion basa, di sisi lain, cenderung bersifat basa dan memiliki kecenderungan untuk menerima proton (H+). Hal ini karena ion basa terbentuk dari molekul basa yang memiliki kecenderungan untuk menerima proton demi mencapai kestabilan. Contohnya adalah ion hidroksida (OH-). Molekul basa amonium (NH4OH) dapat menerima satu proton untuk membentuk ion hidroksida yang bermuatan negatif. Ion hidroksida ini sering terdapat dalam larutan basa kuat dan berperan penting dalam proses pengolahan air minum dan produksi sabun.
Ion asam dan ion basa memiliki sifat dan perilaku yang berbeda dalam reaksi kimia. Ion asam cenderung bersifat asam dan memiliki kecenderungan untuk melepaskan proton (H+). Hal ini karena ion asam terbentuk dari molekul asam yang memiliki kecenderungan untuk melepaskan proton demi mencapai kestabilan. Ion asam sering terlibat dalam reaksi netralisasi dengan ion basa untuk membentuk senyawa netral. Contohnya adalah reaksi antara ion hidrogen sulfat (HSO4-) dan ion hidroksida (OH-), yang menghasilkan senyawa netral air (H2O) dan garam sulfat (SO42-). Reaksi ini merupakan contoh dari reaksi asam-basa yang penting dalam kimia.
Ion basa, di sisi lain, cenderung bersifat basa dan memiliki kecenderungan untuk menerima proton (H+). Hal ini karena ion basa terbentuk dari molekul basa yang memiliki kecenderungan untuk menerima proton demi mencapai kestabilan. Ion basa juga sering terlibat dalam reaksi netralisasi dengan ion asam untuk membentuk senyawa netral. Contohnya adalah reaksi antara ion hidroksida (OH-) dan ion asam klorida (HCl), yang menghasilkan senyawa netral air (H2O) dan garam klorida (Cl-). Reaksi ini juga merupakan contoh dari reaksi asam-basa yang penting dalam kimia.
Ion Kompleks
Ion kompleks merupakan istilah yang digunakan untuk menggambarkan ion yang terbentuk ketika suatu molekul atau ion logam membentuk ikatan dengan atom atau molekul lainnya, yang disebut dengan ligan. Ion kompleks ini memiliki struktur yang lebih kompleks dan sering memiliki sifat dan perilaku yang berbeda dengan ion yang terbentuk dari atom tunggal.
Proses pembentukan ion kompleks melibatkan interaksi antara ligan dengan ion logam. Ligan adalah molekul atau ion yang memiliki pasangan elektron yang dapat berikatan dengan ion logam. Contohnya adalah ion kompleks besi(II) sulfat (FeSO4). Dalam ion kompleks ini, ion besi(II) (Fe2+) membentuk ikatan dengan ligan sulfat (SO42-). Sulfat berperan sebagai ligan yang berikatan dengan ion besi(II) dan membentuk struktur kompleks yang stabil. Ion kompleks besi(II) sulfat ini sering digunakan dalam industri pengolahan logam dan juga memiliki peran penting dalam suplemen zat besi untuk tubuh manusia.
Penggunaan Ion Kompleks dalam Industri dan Kehidupan Sehari-hari
Ion kompleks memiliki berbagai aplikasi dalam industri dan kehidupan sehari-hari. Salah satu aplikasi yang penting adalah dalam industri kimia, di mana ion kompleks digunakan sebagai katalisator dalam berbagai reaksi kimia. Contohnya adalah ion kompleks tembaga(II) klorida (CuCl2), yang digunakan dalam reaksi oksidasi-reduksi dan dalam produksi pigmen dan cat.
Selain itu, ion kompleks juga digunakan dalam industri pengolahan logam, di mana ion kompleks membantu dalam pemisahan dan pemurnian logam-logam tertentu. Contohnya adalah ion kompleks perak nitrat (AgNO3), yang digunakan dalam proses pemurnian perak dari bijih perak.
Dalam kehidupan sehari-hari, ion kompleks juga berperan penting dalam bidang medis. Ion kompleks digunakan dalam pembuatan obat-obatan, seperti obat kemoterapi yang digunakan dalam pengobatan kanker. Ion kompleks juga digunakan dalam analisis kualitatif dan kuantitatif dalam laboratorium medis.
Ion Radikal
Ion radikal adalah istilah yang digunakan untuk menggambarkan ion yang memiliki muatan listrik dan juga memiliki satu atau lebih elektron yang tidak berpasangan. Ion radikal sering memiliki sifat dan perilaku yang berbeda dengan ion yang memiliki pasangan elektron yang berpasangan secara lengkap.
Ion radikal terbentuk ketika suatu molekul atau ion kehilangan atau mendapatkan satu elektron. Contohnya adalah ion radikal hidroksil (OH·), yang terbentuk ketika molekul air (H2O) kehilangan satu elektron. Ion radikal hidroksil ini memiliki sifat yang sangat reaktif dan sering terlibat dalam reaksi oksidasi-reduksi dalam tubuh manusia.
Pengaruh Ion Radikal dalam Tubuh Manusia
Ion radikal memiliki dampak yang signifikan dalam tubuh manusia. Ion radikal dapat berinteraksi dengan molekul-molekul lain dalam tubuh, seperti lipid, protein, dan DNA. Interaksi ini dapat menghasilkan kerusakan pada struktur molekul tersebut dan mengganggu fungsi normal sel.
Kerusakan yang diakibatkan oleh ion radikal ini dapat menyebabkan berbagai masalah kesehatan, seperti penuaan dini, penyakit jantung, kanker, dan gangguan neurologis. Oleh karena itu, penting untuk menjaga keseimbangan antara ion radikal dan antioksidan dalam tubuh untuk melindungi sel-sel dari kerusakan yang disebabkan oleh radikal bebas.
Ion Spektator
Ion spektator adalah istilah yang digunakan untuk menggambarkan ion yang tidak berpartisipasi langsung dalam reaksi kimia. Ion spektator memiliki peran yang cukup penting dalam reaksi tersebut, namun tidak mengalami perubahan muatan atau struktur dalam reaksi tersebut.
Contohnya adalah dalam reaksi netralisasi antara asam klorida (HCl) dan natrium hidroksida (NaOH) yang menghasilkan air (H2O) dan garam dapur (NaCl). Dalam reaksi ini, ion natrium (Na+) dan ion klorida (Cl-) adalah ion spektator. Ion spektator ini tidak mengalami perubahan muatan atau struktur, namun berperan penting dalam menjaga keseimbangan reaksi dan membantu dalam pembentukan senyawa netral.
Peran Ion Spektator dalam Reaksi Kimia
Ion spektator memiliki peran penting dalam reaksi kimia. Ion spektator membantu dalam menjaga keseimbangan reaksi dengan menyeimbangkan jumlah muatan positif dan negatif. Ion spektator juga membantu dalam pembentukan senyawa netral dan memastikan bahwa reaksi berjalan efisien.
Selain itu, ion spektator juga mempengaruhi laju reaksi dan kecepatan perubahan dalam reaksi kimia. Ion spektator dapat mempengaruhi kecepatan reaksi dengan mempengaruhi energi aktivasi dan interaksi antara molekul-molekul reaktan.
Ion dalam Elektrolit
Ion dalam elektrolit adalah ion yang terbentuk ketika senyawa terurai menjadi ion-ion di dalam larutan. Elektrolit adalah senyawa yang dapat menghantarkan arus listrik karena larut dalam air atau cairan lainnya. Ketika senyawa elektrolit larut, molekul-molekul senyawa tersebut akan terurai menjadi ion-ion yang bermuatan positif dan negatif.
Contoh elektrolit adalah garam dapur (NaCl), asam sulfat (H2SO4), dan basa natrium hidroksida (NaOH). Ketika garam dapur larut dalam air, ion natrium (Na+) dan ion klorida (Cl-) terbentuk. Ion-ion ini dapat menghantarkan arus listrik dalam larutan elektrolit. Demikian pula, ketika asam sulfat larut dalam air, ion hidrogen (H+) dan ion sulfat (SO42-) terbentuk. Ion-ion ini juga dapat menghantarkan arus listrik dalam larutan elektrolit.
Peran Ion dalam Elektrolit dalam Tubuh Manusia
Ion dalam elektrolit memainkan peran penting dalam tubuh manusia. Tubuh manusia mengandalkan keseimbangan ion dalam elektrolit untuk menjaga fungsi normal sel, sistem saraf, dan keseimbangan cairan dalam tubuh.
Ion dalam elektrolit, seperti natrium (Na+), kalium (K+), klorida (Cl-), kalsium (Ca2+), dan magnesium (Mg2+), berperan dalam mengatur keseimbangan air dan elektrolit dalam tubuh. Ion-ion ini membantu dalam menjaga tekanan osmotik, keseimbangan pH, dan kontraksi otot yang normal.
Ion dalam elektrolit juga berperan dalam transmisi sinyal saraf. Ion-ion seperti natrium, kalium, dan kalsium memainkan peran penting dalam proses depolarisasi dan repolarisasi dalam sel saraf. Proses ini memungkinkan transmisi sinyal listrik melalui sistem saraf, termasuk sinyal yang terkait dengan gerakan otot, persepsi sensorik, dan fungsi kognitif.
Ketidakseimbangan ion dalam elektrolit dalam tubuh manusia dapat menyebabkan gangguan kesehatan serius. Misalnya, kekurangan natrium dalam tubuh dapat menyebabkan dehidrasi dan gangguan fungsi otot. Kekurangan kalium dapat menyebabkan kelemahan otot dan gangguan irama jantung. Kekurangan kalsium dapat menyebabkan kerapuhan tulang dan risiko patah tulang. Oleh karena itu, penting untuk menjaga keseimbangan ion dalam elektrolit dengan mengonsumsi makanan yang kaya akan elektrolit dan menjaga asupan cairan yang cukup.
Kesimpulan
Pengertian ion dan contohnya merupakan konsep yang penting dalam dunia kimia. Ion adalah atom atau molekul yang memiliki muatan listrik karena jumlah elektron tidak seimbang dengan jumlah proton. Ion dapat terbentuk melalui proses pelepasan atau penerimaan elektron. Terdapat berbagai jenis ion, seperti kation dan anion, ion monoatomik dan poliatomik, ion logam dan nonlogam, serta ion monopositif dan mononegatif. Selain itu, terdapat juga ion polipositif dan polinegatif, ion asam dan ion basa, ion kompleks, ion radikal, ion spektator, dan ion dalam elektrolit.
Memahami konsep ini sangat penting dalam memahami berbagai reaksi kimia, sifat, dan perilaku ion dalam berbagai situasi. Penggunaan istilah dan konsep ini tidak hanya relevan dalam bidang kimia, tetapi juga memiliki aplikasi yang luas dalam industri, kesehatan, dan kehidupan sehari-hari. Dengan pemahaman yang baik tentang pengertian ion dan contohnya, kita dapat lebih memahami bagaimana ion mempengaruhi dunia kimia dan peran mereka dalam menjaga keseimbangan dan fungsi normal dalam tubuh manusia.
