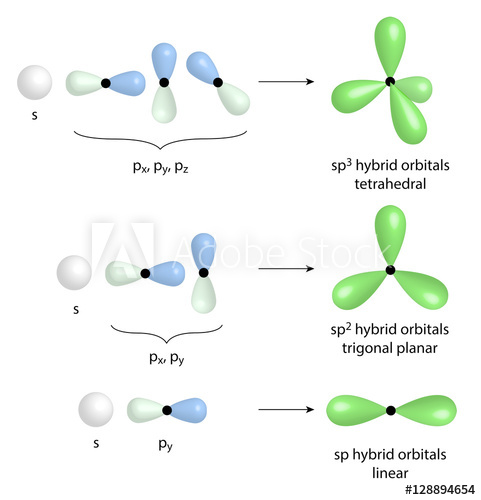
Pada artikel ini, kita akan membahas tentang hibridisasi sp3, yang merupakan salah satu konsep penting dalam kimia. Hibridisasi sp3 mengacu pada proses penggabungan orbital atom untuk membentuk ikatan kovalen dalam molekul. Dalam hibridisasi sp3, orbital atom yang berbeda jenis dan energi akan digabungkan menjadi orbital hibrida yang baru.
Proses hibridisasi sp3 terjadi ketika atom pusat membentuk ikatan dengan empat atom lainnya dalam molekul. Dalam hibridisasi ini, orbital s dan tiga orbital p dari atom pusat bergabung membentuk empat orbital hibrida sp3 yang setara. Keempat orbital hibrida ini berorientasi secara spasial membentuk sudut 109,5 derajat satu sama lain, menghasilkan struktur molekul yang simetris.
Pengertian Hibridisasi sp3
Hibridisasi sp3 adalah proses di mana orbital atom bergabung untuk membentuk orbital hibrida sp3 yang digunakan untuk membentuk ikatan kovalen dalam molekul. Pada hibridisasi sp3, orbital s dan tiga orbital p dari atom pusat bergabung membentuk empat orbital hibrida sp3 yang setara. Orbital hibrida ini memiliki bentuk yang mirip dengan lobus-s yang memperluas cakupan orbital atom pusat, sehingga memungkinkan pembentukan ikatan dengan atom lain.
Pada umumnya, hibridisasi sp3 terjadi pada atom karbon, nitrogen, oksigen, belerang, dan fosfor dalam senyawa organik dan anorganik. Dalam senyawa organik, hibridisasi sp3 pada atom karbon sangat umum dan penting untuk membentuk rangka karbon dalam molekul organik.
Jenis-jenis Hibridisasi sp3
Ada beberapa jenis hibridisasi sp3, tergantung pada jumlah orbital yang terlibat dalam proses hibridisasi. Jenis-jenis hibridisasi sp3 antara lain:
- Hibridisasi sp3 pada atom karbon: Atom karbon dapat mengalami hibridisasi sp3 ketika membentuk ikatan dengan empat atom lainnya dalam molekul.
- Hibridisasi sp3 pada atom nitrogen: Atom nitrogen juga dapat mengalami hibridisasi sp3 ketika membentuk ikatan dengan empat atom lainnya dalam molekul.
- Hibridisasi sp3 pada atom oksigen: Atom oksigen dapat mengalami hibridisasi sp3 ketika membentuk ikatan dengan dua atom lainnya dalam molekul.
- Hibridisasi sp3 pada atom belerang: Atom belerang juga dapat mengalami hibridisasi sp3 ketika membentuk ikatan dengan dua atom lainnya dalam molekul.
- Hibridisasi sp3 pada atom fosfor: Atom fosfor dapat mengalami hibridisasi sp3 ketika membentuk ikatan dengan lima atom lainnya dalam molekul.
Proses Hibridisasi sp3
Proses hibridisasi sp3 terjadi dalam beberapa tahap. Tahap-tahap ini melibatkan penggabungan orbital s dan p dari atom pusat untuk membentuk orbital hibrida sp3. Berikut adalah tahapan proses hibridisasi sp3:
Pertama, Orbital s bersatu dengan tiga orbital p
Dalam tahap pertama, orbital s atom pusat bergabung dengan tiga orbital p yang memiliki orientasi yang berbeda. Gabungan ini membentuk empat orbital hibrida sp3 yang setara. Keempat orbital ini disebut orbital hibrida sp3 karena merupakan kombinasi antara orbital s dan tiga orbital p.
Kedua, Pembentukan Sudut Ikatan
Setelah orbital hibrida sp3 terbentuk, mereka mengadopsi susunan spasial yang simetris. Keempat orbital hibrida ini terletak pada sudut 109,5 derajat satu sama lain, membentuk struktur molekul yang stabil dan simetris. Sudut ikatan ini penting karena menentukan bentuk molekul dan kestabilannya.
Ketiga, Pembentukan Ikatan dengan Atom Lain
Setelah orbital hibrida sp3 terbentuk, mereka dapat membentuk ikatan kovalen dengan atom lain dalam molekul. Masing-masing orbital hibrida sp3 dapat berpasangan dengan elektron dari orbital atom lain, membentuk ikatan kovalen yang kuat dan stabil. Jumlah orbital hibrida sp3 yang terbentuk selalu sama dengan jumlah ikatan yang dibentuk oleh atom pusat. Misalnya, atom karbon yang mengalami hibridisasi sp3 membentuk empat ikatan kovalen dengan atom lain.
Manfaat Hibridisasi sp3 dalam Kimia
Hibridisasi sp3 memiliki manfaat yang signifikan dalam kimia. Beberapa manfaat utama dari hibridisasi sp3 adalah:
Peningkatan Stabilitas Molekul
Hibridisasi sp3 dapat meningkatkan stabilitas molekul karena membantu dalam pembentukan ikatan kovalen yang kuat. Melalui hibridisasi sp3, orbital atom dapat bergabung dan membentuk orbital hibrida yang lebih stabil. Hal ini memungkinkan atom untuk berbagi elektron dan membentuk ikatan kovalen yang kuat dengan atom lain.
Peningkatan Sifat Kimia Molekul
Hibridisasi sp3 juga mempengaruhi sifat kimia molekul. Dalam molekul organik, hibridisasi sp3 pada atom karbon memungkinkan atom karbon untuk membentuk ikatan dengan atom lainnya, membentuk rangka karbon yang kompleks. Rangka karbon yang kompleks ini memungkinkan berbagai macam senyawa organik dengan sifat dan reaktivitas yang berbeda-beda.
Peningkatan Kestabilan Geometri Molekul
Hibridisasi sp3 juga mempengaruhi kestabilan geometri molekul. Melalui hibridisasi sp3, keempat orbital hibrida sp3 terletak pada sudut 109,5 derajat satu sama lain. Sudut ini menghasilkan molekul yang simetris dan stabil secara geometri. Kestabilan geometri ini penting karena mempengaruhi sifat fisik dan reaktivitas molekul.
Contoh Hibridisasi sp3 dalam Molekul Organik
Hibridisasi sp3 sangat umum dalam molekul organik. Beberapa contoh molekul organik yang mengalami hibridisasi sp3 adalah:
Metana (CH4)
Metana adalah contoh yang paling sederhana dari molekul yang mengalami hibridisasi sp3. Dalam metana, atom karbon mengalami hibridisasi sp3 dan membentuk empat ikatan kovalen dengan empat atom hidrogen. Atom karbon dalam metana memiliki empat orbital hibrida sp3 yang terletak pada sudut 109,5 derajat satu sama lain.
Etena (C2H4)
Etena adalah contoh lain dari molekul organik yang mengalami hibridisasi sp3. Dalam etena, atom karbon pada setiap molekul mengalami hibridisasi sp3 dan membentuk tiga ikatan kovalen dengan tiga atom hidrogen dan satu ikatan rangkap dengan atom karbon lainnya. Atom karbon dalam etena memiliki empat orbital hibrida sp3 yang terletak pada sudut 109,5 derajat satu sama lain.
Propana (C3H8)
Propana adalah contoh lain dari molekul organik yang mengalami hibridisasi sp3. Dalam propana, tiga atom karbon mengalami hibridisasi sp3 dan membentuk ikatan kovalen dengan atom karbon dan hidrogen lainnya. Setiap atom karbon dalam propana memiliki empat orbital hibrida sp3 yang terletak pada sudut 109,5 derajat satu sama lain.
Hibridisasi sp3 pada Atom Karbon
Hibridisasi sp3 pada atom karbon sangat umum dalam senyawa organik. Atom karbon dapat mengalami hibridisasi sp3 ketika membentuk ikatan dengan empat atom lainnya dalam molekul. Hibridisasi sp3 pada atom karbon memungkinkan pembentukan rangka karbon yang kompleks dan beragam dalam molekul organik.
Pentingnya Hibridisasi sp3 pada Atom Karbon
Hibridisasi sp3 pada atom karbon adalah konsep yang sangat penting dalam kimia organik. Atom karbon memiliki empat elektron valensi dan dalam hibridisasi sp3, keempat elektron ini digunakan untuk membentuk empat ikatan kovalen dengan atom lain. Hibridisasi sp3 memungkinkan atom karbon untuk membentuk ikatan dengan atom hidrogen, atom karbon lain, dan atom lainnya seperti nitrogen, oksigen, dan belerang.
Contoh Molekul Organik dengan Hibridisasi sp3 pada Atom Karbon
Berikut adalah beberapa contoh molekul organik yang mengalami hibridisasi sp3 pada atom karbon:
Metana (CH4)
Metana adalah contoh yang paling sederhana dari molekul organik yang mengalami hibridisasi sp3 pada atom karbon. Dalam metana, atom karbon mengalami hibridisasi sp3 dan membentuk empat ikatan kovalen dengan empat atom hidrogen. Atom karbon dalam metana memiliki empat orbital hibrida sp3 yang terletak pada sudut 109,5 derajat satu sama lain.
Etana (C2H6)
Etana adalah molekul organik yang terdiri dari dua atom karbon dan enam atom hidrogen. Setiap atom karbon dalam etana mengalami hibridisasi sp3 dan membentuk tiga ikatan kovalen dengan tiga atom hidrogen dan satu ikatan rangkap dengan atom karbon lainnya. Atom karbon dalam etana memiliki empat orbital hibrida sp3 yang terletak pada sudut 109,5 derajat satu sama lain.
Propana (C3H8)
Propana adalah molekul organik yang terdiri dari tiga atom karbon dan delapan atom hidrogen. Setiap atom karbon dalam propana mengalami hibridisasi sp3 dan membentuk ikatan kovalen dengan atom karbon dan hidrogen lainnya. Atom karbon dalam propana memiliki empat orbital hibrida sp3 yang terletak pada sudut 109,5 derajat satu sama lain.
Hibridisasi sp3 pada Atom Nitrogen
Selain atom karbon, atom nitrogen juga dapat mengalami hibridisasi sp3 ketika membentuk ikatan dengan empat atom lainnya dalam molekul. Hibridisasi sp3 pada atom nitrogen memungkinkan pembentukan senyawa nitrogen yang penting dalam kimia organik dan anorganik.
Pentingnya Hibridisasi sp3 pada Atom Nitrogen
Hibridisasi sp3 pada atom nitrogen memainkan peran penting dalam senyawa organik dan anorganik. Atom nitrogen memiliki tiga elektron valensi dan dalam hibridisasi sp3, tiga elektron ini digunakan untuk membentuk tiga ikatan kovalen dengan atom lain. Hibridisasi sp3 pada atom nitrogen memungkinkan pembentukan senyawa seperti amonia dan amina yang memiliki sifat dan reaktivitas yang berbeda-beda.
Contoh Molekul dengan Hibridisasi sp3 pada Atom Nitrogen
Berikut adalah beberapa contoh molekul yang mengalami hibridisasi sp3 pada atom nitrogen:
Amonia (NH3)
Amonia adalah contoh yang paling sederhana dari molekul yang mengalami hibridisasi sp3 pada atom nitrogen. Dalam amonia, atom nitrogen mengalami hibridisasi sp3 dan membentuk tiga ikatan kovalen dengan tiga atom hidrogen. Atom nitrogen dalam amonia memiliki tiga orbital hibrida sp3 yang terletak pada sudut 109,5 derajat satu sama lain.
Metilamina (CH3NH2)
Metilamina adalah molekul organik yang mengandung satu atom karbon, tiga atom hidrogen, dan satu atom nitrogen. Atom nitrogen dalam metilamina mengalami hibridisasi sp3 dan membentuk tiga ikatan kovalen dengan tiga atom hidrogen dan satu ikatan rangkap dengan atom karbon. Atom nitrogen dalam metilamina memiliki tiga orbital hibrida sp3 yang terletak pada sudut 109,5 derajat satu sama lain.
Etilamina (C2H5NH2)
Etilamina adalah molekul organik yang mengandung dua atom karbon, lima atom hidrogen, dan satu atom nitrogen. Atom nitrogen dalam etilamina mengalami hibridisasi sp3 dan membentuk tiga ikatan kovalen dengan tiga atom hidrogen dan satu ikatan rangkap dengan atom karbon. Atom nitrogen dalam etilamina memiliki tiga orbital hibrida sp3 yang terletak pada sudut 109,5 derajat satu sama lain.
Hibridisasi sp3 pada Atom Oksigen
Hibridisasi sp3 pada atom oksigen terjadi ketika atom oksigen membentuk dua ikatan kovalen dengan dua atom lain dalam molekul. Hibridisasi sp3 pada atom oksigen memungkinkan pembentukan senyawa seperti air dan etanol yang memiliki sifat dan reaktivitas yang berbeda-beda.
Pentingnya Hibridisasi sp3 pada Atom Oksigen
Hibridisasi sp3 pada atom oksigen memiliki peran penting dalam senyawa organik dan anorganik. Atom oksigen memiliki enam elektron valensi dan dalam hibridisasi sp3, enam elektron ini digunakan untuk membentuk dua ikatan kovalen dengan atom lain. Hibridisasi sp3 pada atom oksigen memungkinkan pembentukan senyawa seperti air dan etanol yang memiliki sifat pelarut, sifat polar, dan reaktivitas yang berbeda-beda.
Contoh Molekul dengan Hibridisasi sp3 pada Atom Oksigen
Berikut adalah beberapa contoh molekul yang mengalami hibridisasi sp3 pada atom oksigen:
Air (H2O)
Air adalah contoh yang paling sederhana dari molekul yang mengalami hibridisasi sp3 pada atom oksigen. Dalam air, atom oksigen mengalami hibridisasi sp3 dan membentuk dua ikatan kovalen dengan dua atom hidrogen. Atom oksigen dalam air memiliki dua orbital hibrida sp3 yang terletak pada sudut 109,5 derajat satu sama lain.
Etanol (C2H5OH)
Etanol adalah molekul organik yang mengandung dua atom karbon, enam atom hidrogen, dan satu atom oksigen. Atom oksigen dalam etanol mengalami hibridisasi sp3 dan membentuk dua ikatan kovalen dengan dua atom hidrogen dan satu ikatan rangkap dengan atom karbon. Atom oksigen dalam etanol memiliki dua orbital hibrida sp3 yang terletak pada sudut 109,5 derajat satu sama lain.
Hibridisasi sp3 pada Atom Belerang
Hibridisasi sp3 pada atom belerang terjadi ketika atom belerang membentuk dua ikatan kovalen dengan dua atom lain dalam molekul. Hibridisasi sp3 pada atom belerang memungkinkan pembentukan senyawa seperti metilmerkaptan dan dimetil sulfida yang memiliki sifat dan reaktivitas yang berbeda-beda.
Pentingnya Hibridisasi sp3 pada Atom Belerang
Hibridisasi sp3 pada atom belerang memiliki peran penting dalam senyawa organik dan anorganik. Atom belerang memiliki enam elektron valensi dan dalam hibridisasi sp3, enam elektron ini digunakan untuk membentuk dua ikatan kovalen dengan atom lain. Hibridisasi sp3 pada atom belerang memungkinkan pembentukan senyawa seperti metil merkaptan dan dimetil sulfida yang memiliki sifat aroma, sifat pelarut, dan reaktivitas yang berbeda-beda.
Contoh Molekul dengan Hibridisasi sp3 pada Atom Belerang
Berikut adalah beberapa contoh molekul yang mengalami hibridisasi sp3 pada atom belerang:
Metil Merkaptan (CH3SH)
Metil merkaptan adalah senyawa organik yang mengandung satu atom karbon, tiga atom hidrogen, dan satu atom belerang. Atom belerang dalam metil merkaptan mengalami hibridisasi sp3 dan membentuk dua ikatan kovalen dengan dua atom hidrogen. Atom belerang dalam metil merkaptan memiliki dua orbital hibrida sp3 yang terletak pada sudut 109,5 derajat satu sama lain.
Dimetil Sulfida (CH32S)
Dimetil sulfida adalah senyawa organik yang mengandung dua atom karbon, enam atom hidrogen, dan satu atom belerang. Atom belerang dalam dimetil sulfida mengalami hibridisasi sp3 dan membentuk dua ikatan kovalen dengan dua atom hidrogen dan satu ikatan rangkap dengan atom karbon. Atom belerang dalam dimetil sulfida memiliki dua orbital hibrida sp3 yang terletak pada sudut 109,5 derajat satu sama lain.
Hibridisasi sp3 pada Atom Fosfor
Hibridisasi sp3 pada atom fosfor terjadi ketika atom fosfor membentuk lima ikatan kovalen dengan lima atom lain dalam molekul. Hibridisasi sp3 pada atom fosfor memungkinkan pembentukan senyawa seperti trimetil fosfit dan tris(diisopropil) fosfina yang memiliki sifat dan reaktivitas yang berbeda-beda.
Pentingnya Hibridisasi sp3 pada Atom Fosfor
Hibridisasi sp3 pada atom fosfor memiliki peran penting dalam senyawa organik dan anorganik. Atom fosfor memiliki lima elektron valensi dan dalam hibridisasi sp3, lima elektron ini digunakan untuk membentuk lima ikatan kovalen dengan atom lain. Hibridisasi sp3 pada atom fosfor memungkinkan pembentukan senyawa seperti trimetil fosfit dan tris(diisopropil) fosfina yang memiliki sifat dan reaktivitas yang berbeda-beda.
Contoh Molekul dengan Hibridisasi sp3 pada Atom Fosfor
Berikut adalah beberapa contoh molekul yang mengalami hibridisasi sp3 pada atom fosfor:
Trimetil Fosfit (P(CH3)3)
Trimetil fosfit adalah senyawa organik yang mengandung satu atom fosfor dan tiga gugus metil (-CH3). Atom fosfor dalam trimetil fosfit mengalami hibridisasi sp3 dan membentuk lima ikatan kovalen dengan lima atom hidrogen dan atom karbon. Atom fosfor dalam trimetil fosfit memiliki lima orbital hibrida sp3 yang terletak pada sudut 109,5 derajat satu sama lain.
Tris(diisopropil) Fosfina [(CH3)2CH]3P
Tris(diisopropil) fosfina adalah senyawa organik yang mengandung satu atom fosfor dan tiga gugus diisopropil (-CH(CH3)2). Atom fosfor dalam tris(diisopropil) fosfina mengalami hibridisasi sp3 dan membentuk lima ikatan kovalen dengan lima atom hidrogen dan atom karbon. Atom fosfor dalam tris(diisopropil) fosfina memiliki lima orbital hibrida sp3 yang terletak pada sudut 109,5 derajat satu sama lain.
Dengan memahami konsep dan contoh-contoh hibridisasi sp3 pada atom karbon, nitrogen, oksigen, belerang, dan fosfor, kita dapat lebih memahami struktur dan sifat molekul dalam kimia. Hibridisasi sp3 adalah konsep yang penting dalam memahami ikatan kovalen dalam molekul dan memprediksi sifat kimia dari senyawa-senyawa yang terbentuk.
