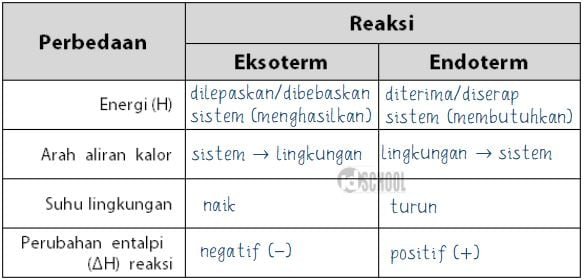
Perbedaan reaksi eksoterm dan endoterm adalah topik yang sangat penting dalam ilmu kimia. Dalam artikel ini, kita akan menjelaskan secara rinci perbedaan antara kedua jenis reaksi ini. Mari kita mulai dengan memahami apa yang dimaksud dengan reaksi eksoterm dan reaksi endoterm.
Reaksi Eksoterm
Reaksi eksoterm adalah jenis reaksi kimia yang melepaskan panas ke lingkungan sekitarnya. Dalam reaksi ini, energi yang dilepaskan lebih besar daripada energi yang diperlukan untuk memulai reaksi. Dalam hal ini, reaksi eksoterm dapat dianggap sebagai reaksi yang "membakar" atau "melepaskan" energi.
Proses Reaksi Eksoterm
Proses reaksi eksoterm dimulai dengan adanya energi awal yang disebut energi aktivasi. Energi aktivasi diperlukan untuk memulai reaksi dan mengatasi ikatan-ikatan kimia yang ada di dalam reaktan. Setelah energi aktivasi tercapai, reaksi akan berlangsung dengan cepat dan energi yang dilepaskan oleh reaksi akan melebihi energi yang diperlukan untuk memulai reaksi.
Contoh Reaksi Eksoterm
Terdapat banyak contoh reaksi eksoterm dalam kehidupan sehari-hari. Salah satu contoh yang paling umum adalah pembakaran kayu. Ketika kayu terbakar, panas dilepaskan ke lingkungan sekitarnya. Contoh lain termasuk reaksi pembusukan, reaksi penguraian bahan kimia, dan reaksi oksidasi. Semua contoh ini menghasilkan panas sebagai produk sampingan.
Pengaruh Reaksi Eksoterm Terhadap Lingkungan
Reaksi eksoterm dapat mempengaruhi lingkungan sekitarnya dengan melepaskan panas. Hal ini dapat menyebabkan peningkatan suhu atau perubahan kondisi termal di sekitar reaksi. Sebagai contoh, ketika bahan bakar dibakar, panas yang dihasilkan dapat meningkatkan suhu di sekitarnya. Oleh karena itu, reaksi eksoterm sering kali terasa hangat atau bahkan panas.
Kecepatan Reaksi Eksoterm
Kecepatan reaksi eksoterm cenderung lebih tinggi daripada kecepatan reaksi endoterm. Hal ini disebabkan oleh energi panas yang dilepaskan oleh reaksi eksoterm. Energi panas ini dapat membantu mempercepat reaksi dengan meningkatkan kecepatan partikel-partikel reaktan dan kecepatan tumbukan antara partikel-partikel tersebut.
Reaksi Endoterm
Reaksi endoterm adalah jenis reaksi kimia yang menyerap panas dari lingkungan sekitarnya. Dalam reaksi ini, energi yang diperlukan untuk memulai reaksi lebih besar daripada energi yang dilepaskan. Dalam hal ini, reaksi endoterm dapat dianggap sebagai reaksi yang "mengonsumsi" atau "mengabsorbsi" energi.
Proses Reaksi Endoterm
Proses reaksi endoterm dimulai dengan adanya energi awal yang disebut energi aktivasi. Energi aktivasi diperlukan untuk memulai reaksi dan mengatasi ikatan-ikatan kimia yang ada di dalam reaktan. Namun, dalam reaksi endoterm, energi yang diperlukan untuk mencapai energi aktivasi lebih besar daripada energi yang dilepaskan oleh reaksi.
Contoh Reaksi Endoterm
Terdapat banyak contoh reaksi endoterm dalam kehidupan sehari-hari. Salah satu contoh yang paling umum adalah fotosintesis. Selama fotosintesis, tumbuhan menyerap energi matahari untuk mengubah air dan karbon dioksida menjadi glukosa dan oksigen. Contoh lain termasuk penguapan air, reaksi pembekuan, dan proses pendinginan.
Pengaruh Reaksi Endoterm Terhadap Lingkungan
Reaksi endoterm dapat mengakibatkan penurunan suhu atau perubahan kondisi termal karena menyerap panas dari lingkungan sekitarnya. Sebagai contoh, saat air menguap, panas diambil dari lingkungan sekitarnya sehingga suhu sekitar dapat menurun. Oleh karena itu, reaksi endoterm sering kali terasa dingin atau membutuhkan sumber panas eksternal.
Kecepatan Reaksi Endoterm
Kecepatan reaksi endoterm cenderung lebih lambat daripada kecepatan reaksi eksoterm. Hal ini disebabkan oleh energi panas yang diperlukan untuk memulai reaksi endoterm. Sebelum reaksi dapat dimulai, energi panas harus diserap terlebih dahulu. Oleh karena itu, reaksi endoterm membutuhkan waktu lebih lama untuk mencapai energi aktivasi dan berlangsung dengan kecepatan yang lebih rendah.
Perbedaan Dalam Diagram Energi
Diagram energi adalah representasi visual dari perubahan energi dalam suatu reaksi kimia. Diagram energi untuk reaksi eksoterm akan menunjukkan bahwa energi awal lebih tinggi daripada energi akhir, dengan jumlah energi yang dilepaskan ditunjukkan sebagai energi aktivasi. Dalam diagram energi untuk reaksi endoterm, energi awal akan lebih rendah daripada energi akhir, dengan jumlah energi yang diperlukan ditunjukkan sebagai energi aktivasi.
Perbedaan Dalam Contoh Aplikasi
Reaksi eksoterm dan endoterm memiliki contoh aplikasi yang berbeda. Reaksi eksoterm digunakan dalam berbagai aplikasi, termasuk pembakaran bahan bakar untuk menghasilkan energi, pemanasan ruangan, dan peledak. Di sisi lain, reaksi endoterm digunakan dalam proses pendinginan, seperti pendinginan makanan atau sistem pendingin ruangan.
Perbedaan Dalam Keseimbangan Reaksi
Keseimbangan reaksi eksoterm dan endoterm juga dapat berbeda. Reaksi eksoterm cenderung memiliki keseimbangan yang condong ke arah produk, karena energi yang dilepaskan oleh reaksi dapat membantu mendorong reaksi ke arah yang diinginkan. Sementara itu, reaksi endoterm cenderung memiliki keseimbangan yang condong ke arah reaktan, karena energi yang diperlukan harus diserap terlebih dahulu sebelum reaksi dapat terjadi.
Perbedaan Dalam Peran Energi Aktivasi
Peran energi aktivasi juga berbeda dalam reaksi eksoterm dan endoterm. Dalam reaksi eksoterm, energi aktivasi cenderung lebih rendah daripada energi yang dilepaskan, sehingga reaksi dapat terjadi dengan mudah. Sementara itu, dalam reaksi endoterm, energi aktivasi cenderung lebih tinggi daripada energi yang diperlukan, sehingga reaksi memerlukan tambahan energi untuk dimulai.
Dalam kesimpulan, perbedaan antara reaksi eksoterm dan endoterm meliputi proses, energi yang terlibat, contoh, pengaruh terhadap lingkungan, kecepatan reaksi, perubahan suhu, diagram energi, contoh aplikasi, keseimbangan reaksi, dan peran energi aktivasi. Memahami perbedaan ini penting dalam memahami dan menerapkan ilmu kimia secara lebih luas.
Sumber:- https://www.khanacademy.org/science/chemistry/thermodynamics-chemistry/endothermic-and-exothermic-reactions/a/exothermic-and-endothermic-reactions
