Titrasi adalah teknik analisis kimia yang digunakan untuk menentukan konsentrasi suatu larutan dengan menggunakan larutan standar. Prinsip kerja titrasi sangat penting untuk dipahami agar dapat melakukan analisis dengan akurat dan menghasilkan data yang dapat dipercaya. Dalam artikel ini, kami akan menjelaskan secara detail dan komprehensif prinsip kerja titrasi serta langkah-langkah yang terlibat dalam prosesnya.
Pengenalan tentang Titrasi
Titrasi adalah metode yang digunakan untuk menentukan konsentrasi suatu zat di dalam larutan. Tujuan utama dari titrasi adalah untuk menemukan jumlah zat yang dianalisis dengan mengukur volume larutan standar yang diperlukan untuk bereaksi sepenuhnya dengan zat tersebut. Titrasi sangat berguna dalam berbagai bidang, termasuk industri, laboratorium, dan penelitian.
Jenis-jenis Titrasi
Ada beberapa jenis titrasi yang umum digunakan, termasuk titrasi asam-basa, titrasi pengendapan, titrasi kompleksometri, dan titrasi redoks. Titrasi asam-basa digunakan untuk menentukan keasaman atau kebasaan suatu larutan, sedangkan titrasi pengendapan digunakan untuk mengendapkan zat tertentu dari larutan. Titrasi kompleksometri digunakan untuk menentukan konsentrasi logam dalam larutan, sedangkan titrasi redoks digunakan untuk menentukan kekuatan oksidator atau reduktor dalam larutan.
Prinsip Dasar Titrasi
Prinsip dasar titrasi adalah bahwa reaksi kimia yang terjadi antara zat yang dianalisis (larutan analit) dan larutan standar yang diketahui konsentrasinya akan mencapai titik ekivalen. Titik ekivalen adalah titik di mana zat yang dianalisis dan larutan standar bereaksi dalam perbandingan stoikiometri yang tepat. Titik ekivalen ditandai dengan perubahan sifat fisik larutan, seperti perubahan warna atau perubahan pH.
Titrasi Asam-Basa
Titrasi asam-basa adalah jenis titrasi yang paling umum digunakan. Tujuan titrasi asam-basa adalah untuk menentukan keasaman atau kebasaan suatu larutan dengan menggunakan larutan standar asam atau basa. Dalam titrasi asam-basa, indikator asam-basa digunakan untuk menunjukkan titik ekivalen, yang ditandai dengan perubahan warna larutan. Beberapa contoh titrasi asam-basa yang umum dilakukan adalah titrasi asam sulfat dengan larutan natrium hidroksida dan titrasi asam asetat dengan larutan natrium hidroksida.
Titrasi Pengendapan
Titrasi pengendapan digunakan untuk mengendapkan zat tertentu dari larutan. Titrasi pengendapan melibatkan penambahan larutan pengendap yang bereaksi dengan zat yang akan diendapkan untuk membentuk endapan. Endapan ini kemudian dipisahkan dan ditimbang untuk menentukan jumlah zat yang dianalisis. Contoh titrasi pengendapan yang umum dilakukan adalah titrasi antara larutan perak nitrat dengan larutan klorida untuk mengendapkan klorida sebagai garam perak klorida.
Titrasi Kompleksometri
Titrasi kompleksometri digunakan untuk menentukan konsentrasi logam dalam larutan. Titrasi ini melibatkan reaksi antara ion logam dengan senyawa kompleksometri, yang membentuk kompleks yang larut dalam air. Perubahan warna yang terjadi saat titrasi digunakan untuk menunjukkan titik ekivalen. Contoh titrasi kompleksometri yang umum dilakukan adalah titrasi antara larutan EDTA (etilendiaminatetraasetat) dengan ion logam seperti kalsium atau magnesium.
Titrasi Redoks
Titrasi redoks melibatkan reaksi oksidasi-reduksi antara zat yang dianalisis dan larutan standar yang diketahui. Dalam titrasi redoks, perubahan dalam bilangan oksidasi zat yang dianalisis digunakan untuk menentukan jumlah zat tersebut. Contoh titrasi redoks yang umum dilakukan adalah titrasi antara larutan kalium permanganat sebagai oksidator dengan larutan besi(II) sulfat sebagai reduktor.
Persiapan Larutan Standar
Persiapan larutan standar sangat penting dalam titrasi. Larutan standar adalah larutan yang diketahui konsentrasinya dan digunakan sebagai pembanding untuk menentukan konsentrasi zat yang dianalisis. Langkah-langkah yang terlibat dalam persiapan larutan standar adalah sebagai berikut:
Pemilihan Zat Kimia
Langkah pertama dalam persiapan larutan standar adalah memilih zat kimia yang akan digunakan sebagai standar. Zat kimia yang baik untuk digunakan sebagai standar harus memiliki kemurnian yang tinggi dan reaksi yang tepat dengan zat yang dianalisis. Contoh zat kimia yang umum digunakan sebagai standar adalah asam sulfat, natrium hidroksida, asam asetat, dan kalium permanganat.
Pengukuran Massa
Setelah zat kimia standar dipilih, langkah berikutnya adalah mengukur massa yang tepat dari zat tersebut. Pengukuran massa harus dilakukan dengan hati-hati menggunakan timbangan analitik yang akurat. Massa yang diukur harus sesuai dengan konsentrasi yang diinginkan untuk larutan standar.
Pengenceran Larutan
Jika zat kimia standar terlalu pekat untuk digunakan langsung, larutan standar harus dilarutkan dengan pelarut yang sesuai. Pengenceran dilakukan dengan menambahkan pelarut secara bertahap sambil mengaduk larutan. Volume pelarut yang ditambahkan harus diukur dengan akurat untuk memastikan konsentrasi larutan standar yang tepat.
Persiapan Larutan Analit
Langkah selanjutnya dalam titrasi adalah mempersiapkan larutan analit yang akan digunakan. Larutan analit adalah larutan yang mengandung zat yang akan dianalisis. Persiapan larutan analit melibatkan langkah-langkah berikut:
Pemilihan Zat Analit
Langkah pertama dalam persiapan larutan analit adalah memilih zat yang akan dianalisis. Zat yang dipilih harus memiliki konsentrasi yang tidak diketahui dan berada dalam bentuk kimia yang sesuai untuk bereaksi dengan larutan standar. Contoh zat yang sering dianalisis melalui titrasi adalah asam asetat, karbonat, dan ion logam seperti kalsium atau besi.
Pengukuran Massa atau Volume
Setelah zat analit dipilih, langkah berikutnya adalah mengukur massa atau volume yang tepat dari zat tersebut. Pengukuran ini harus dilakukan dengan hati-hati menggunakan alat ukur yang akurat. Massa atau volume yang diukur harus sesuai dengan konsentrasi yang diinginkan untuk larutan analit.
Pelarutan dalam Pelarut
Setelah pengukuran, zat analit harus dilarutkan dalam pelarut yang sesuai. Pelarutan dilakukan dengan menggabungkan zat analit dengan pelarut dan mengaduk larutan hingga zat analit terlarut sepenuhnya. Volume pelarut yang digunakan harus diukur dengan akurat untuk memastikan konsentrasi larutan analit yang tepat.
Indikator Titrasi
Indikator titrasi adalah zat kimia yang digunakan untuk menunjukkan titik ekivalen dalam titrasi. Indikator ini mengubah warna saat mencapai titik ekivalen, yang menandakan perubahan dalam sifat larutan. Beberapa jenis indikator titr
Indikator Titrasi (lanjutan)
Beberapa jenis indikator titrasi yang umum digunakan adalah fenolftalein, metil jingga, metil merah, bromtimol biru, dan fenolphtalein. Pemilihan indikator yang tepat sangat penting untuk mendapatkan hasil yang akurat dalam titrasi. Indikator yang dipilih harus memiliki rentang perubahan warna yang sesuai dengan titik ekivalen titrasi yang diharapkan. Misalnya, fenolftalein digunakan sebagai indikator dalam titrasi asam-basa karena mengalami perubahan warna dalam rentang pH tertentu.
Penggunaan Indikator Titrasi
Untuk menggunakan indikator titrasi, beberapa tetes indikator ditambahkan ke dalam larutan analit sebelum titrasi dimulai. Selama titrasi berlangsung, perubahan warna yang terjadi pada larutan menunjukkan titik ekivalen. Penting untuk mengamati perubahan warna dengan hati-hati dan mencatat volume larutan standar yang ditambahkan pada saat terjadi perubahan warna, karena volume ini akan digunakan untuk menghitung konsentrasi zat yang dianalisis.
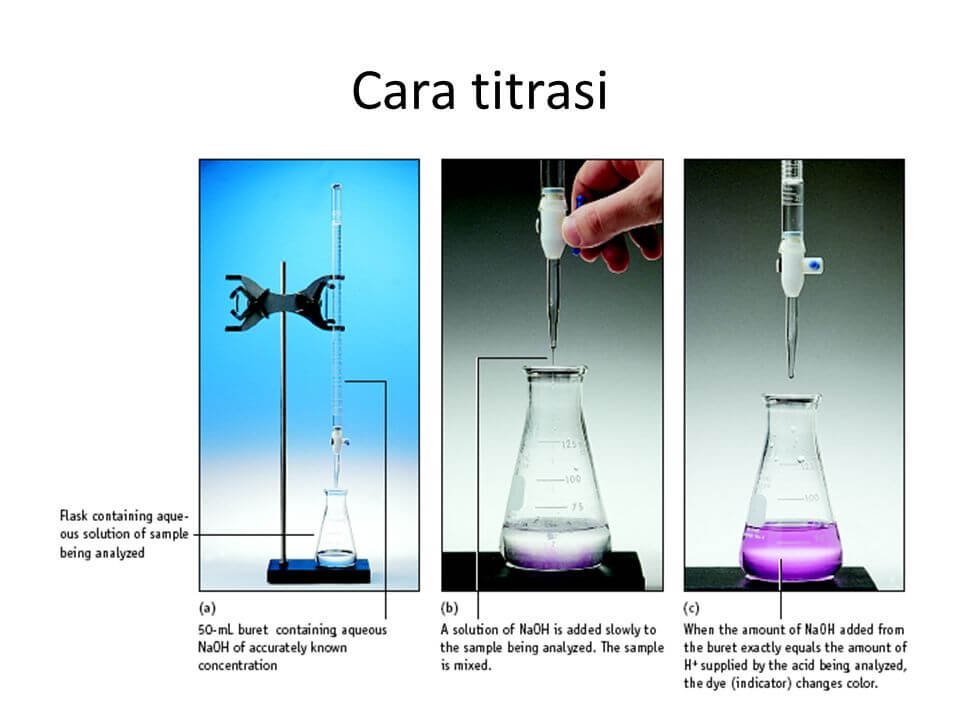
Langkah-langkah Titrasi
Titrasi melibatkan serangkaian langkah yang harus diikuti dengan hati-hati untuk mendapatkan hasil yang akurat. Berikut adalah langkah-langkah umum yang terlibat dalam titrasi:
Persiapan Alat
Sebelum memulai titrasi, pastikan bahwa semua alat yang dibutuhkan telah disiapkan dengan baik. Ini termasuk buret, labu Erlenmeyer, pipet, dan alat pengukur volume lainnya. Pastikan juga bahwa semua alat telah dibersihkan dengan baik untuk menghindari kontaminasi yang dapat mempengaruhi hasil titrasi.
Persiapan Larutan Analit
Larutan analit harus dipersiapkan sesuai dengan langkah-langkah yang telah dijelaskan sebelumnya. Pastikan larutan analit telah terlarut sepenuhnya dan memiliki konsentrasi yang sesuai.
Persiapan Larutan Standar
Seperti larutan analit, pastikan larutan standar juga telah dipersiapkan dengan benar. Perhatikan konsentrasi dan volume larutan standar yang akan digunakan.
Penambahan Indikator
Jika diperlukan, tambahkan beberapa tetes indikator ke dalam larutan analit. Pastikan indikator yang dipilih sesuai dengan jenis titrasi yang akan dilakukan.
Pelaksanaan Titrasi
Titrasi dimulai dengan menambahkan larutan standar perlahan-lahan ke dalam larutan analit. Tambahkan larutan standar dengan menggunakan buret, dan aduk larutan secara terus-menerus selama penambahan. Perhatikan perubahan warna yang terjadi saat titrasi berlangsung.
Pencatatan Volume Larutan Standar
Catat volume larutan standar yang ditambahkan pada saat terjadi perubahan warna atau titik ekivalen. Volume ini akan digunakan untuk menghitung konsentrasi zat yang dianalisis.
Pengulangan Titrasi
Untuk mendapatkan hasil yang akurat, titrasi sering kali perlu diulang beberapa kali. Ulangi titrasi dengan menggunakan volume larutan standar yang lebih dekat dengan volume yang dicatat pada titrasi sebelumnya. Ambil rata-rata dari beberapa hasil titrasi untuk mendapatkan hasil yang lebih presisi.
Titik Akhir Titrasi
Titik akhir titrasi adalah titik di mana reaksi antara larutan analit dan larutan standar mencapai titik ekivalen. Titik ekivalen ditandai dengan perubahan warna atau perubahan sifat fisik larutan. Untuk mencapai titik akhir dengan akurat, metode yang berbeda dapat digunakan, tergantung pada jenis titrasi yang dilakukan.
Penggunaan Indikator
Indikator titrasi digunakan untuk menunjukkan titik ekivalen dengan perubahan warna. Ketika perubahan warna terjadi, ini menandakan bahwa reaksi antara larutan analit dan larutan standar telah mencapai titik ekivalen. Perhatikan perubahan warna dengan hati-hati dan catat volume larutan standar yang ditambahkan pada saat terjadi perubahan warna.
Penggunaan Elektroda
Untuk titrasi redoks, elektroda dapat digunakan untuk menentukan titik akhir. Elektroda akan menghasilkan sinyal listrik yang berubah saat titrasi berlangsung. Perubahan dalam sinyal listrik ini dapat digunakan untuk mengidentifikasi titik akhir titrasi secara akurat.
Penggunaan Kurva Titrasi
Pada beberapa jenis titrasi, seperti titrasi kompleksometri, kurva titrasi dapat digunakan untuk menentukan titik akhir. Kurva titrasi adalah grafik yang menunjukkan hubungan antara volume larutan standar yang ditambahkan dan perubahan konsentrasi zat yang dianalisis. Titik akhir ditentukan berdasarkan perubahan yang diamati pada kurva titrasi.
Kurva Titrasi
Kurva titrasi adalah grafik yang menggambarkan hubungan antara volume larutan standar yang ditambahkan dan perubahan konsentrasi zat yang dianalisis. Kurva titrasi dapat digunakan untuk menentukan titik akhir dan menghasilkan hasil yang lebih akurat. Beberapa titik penting dalam kurva titrasi adalah sebagai berikut:
Peluruhan Awal
Pada awal titrasi, perubahan dalam konsentrasi zat yang dianalisis tidak signifikan karena belum ada penambahan larutan standar. Kurva titrasi akan dimulai dari titik awal yang menunjukkan konsentrasi zat yang dianalisis sebelum titrasi dimulai.
Peluruhan Lambat
Saat larutan standar ditambahkan, perubahan dalam konsentrasi zat yang dianalisis akan semakin signifikan. Kurva titrasi akan menunjukkan peningkatan yang lambat dalam konsentrasi zat yang dianalisis karena larutan standar sedikit demi sedikit bereaksi dengan zat tersebut.
Peluruhan Cepat
Ketika titik ekivalen atau titik akhir titrasi hampir tercapai, perubahan dalam konsentrasi zat yang dianalisis akan menjadi lebih cepat. Kurva titrasi akan menunjukkan peningkatan yang tajam dalam konsentrasi zat yang dianalisis karena larutan standar bereaksi dengan zat tersebut dalam perbandingan stoikiometri yang tepat.
Peluruhan Stabil
Setelah titik akhir tercapai, perubahan dalam konsentrasi zat yang dianalisis akan menjadi stabil. Kurva titrasi akan menunjukkan konsentrasi yang konstan setelah titik akhir, yang menandakan bahwa reaksi antara larutan analit dan larutan standar telah mencapai titik ekivalen.
Kesalahan dalam Titrasi
Titik akhir dan hasil titrasi dapat dipengaruhi oleh beberapa faktor yang dapat menyebabkan kesalahan. Beberapa kesalahan yang umum terjadi dalam titrasi adalah sebagai berikut:
Kesalahan Pada Pengukuran Volume
Kesalahan dalam pengukuran volume larutan standar yang ditambahkan atau volume larutan analit dapat menghasilkan hasil yang tidak akurat. Penting untuk menggunakan alat ukur yang akurat dan membaca volume dengan hati-hati untuk menghindari kesalahan ini.
Kesalahan Pada Pemilihan Indikator
Pemilihan indikator yang tidak sesuai dengan jenis titrasi yang dilakukan dapat menyebabkan kesalahan dalam menentukan titik akhir. Indikator yang dipilih harus memiliki rentangperubahan warna yang sesuai dengan titik ekivalen yang diharapkan. Kesalahan ini dapat dihindari dengan memilih indikator yang tepat berdasarkan jenis titrasi yang dilakukan.
Kesalahan Pada Persiapan Larutan
Jika larutan standar atau larutan analit tidak dipersiapkan dengan benar, ini dapat menyebabkan kesalahan dalam hasil titrasi. Misalnya, jika konsentrasi larutan standar terlalu tinggi atau terlalu rendah, ini akan mempengaruhi hasil titrasi. Penting untuk memperhatikan langkah-langkah persiapan larutan dengan hati-hati dan memastikan bahwa konsentrasi dan volume yang digunakan sesuai dengan kebutuhan titrasi.
Kesalahan Pada Penentuan Titik Akhir
Penentuan titik akhir titrasi dapat menjadi subjektif dan tergantung pada pengamatan pengguna. Kesalahan dapat terjadi jika titik akhir tidak diamati dengan hati-hati atau jika pengguna tidak memiliki pengetahuan yang cukup tentang perubahan yang terjadi pada titik ekivalen. Untuk menghindari kesalahan ini, penting untuk melatih diri dalam mengamati perubahan warna atau menggunakan metode lain yang lebih objektif untuk menentukan titik akhir, seperti menggunakan elektroda atau kurva titrasi.
Kesalahan Pada Pengukuran Buret
Buret adalah alat yang digunakan untuk menambahkan larutan standar secara perlahan-lahan. Kesalahan dalam membaca volume buret dapat menghasilkan volume yang tidak akurat yang ditambahkan ke larutan analit. Penting untuk membaca volume buret dengan hati-hati dan memastikan bahwa alat ukur tersebut dalam kondisi yang baik.
Kesalahan Pada Pengulangan Titrasi
Jika titrasi diulang beberapa kali untuk mendapatkan hasil yang akurat, kesalahan dapat terjadi jika hasil titrasi yang diambil tidak konsisten. Kesalahan ini dapat dihindari dengan mengulang titrasi beberapa kali dan mengambil rata-rata dari hasil yang diperoleh. Penting untuk mencatat hasil titrasi dengan akurat dan menggunakan hasil yang konsisten untuk analisis.
Kesimpulan
Pemahaman yang mendalam tentang prinsip kerja titrasi sangat penting untuk melakukan analisis kimia dengan akurat. Dalam artikel ini, kami telah menjelaskan secara detail dan komprehensif prinsip kerja titrasi serta langkah-langkah yang terlibat dalam prosesnya. Titrasi adalah teknik analisis yang digunakan untuk menentukan konsentrasi zat dalam larutan dengan menggunakan larutan standar. Jenis-jenis titrasi yang umum digunakan meliputi titrasi asam-basa, titrasi pengendapan, titrasi kompleksometri, dan titrasi redoks.
Persiapan larutan standar dan larutan analit, pemilihan indikator yang tepat, langkah-langkah titrasi yang akurat, dan penentuan titik akhir yang akurat sangat penting untuk memperoleh hasil yang akurat dalam titrasi. Kesalahan dalam titrasi dapat terjadi akibat kesalahan pengukuran volume, pemilihan indikator yang tidak tepat, persiapan larutan yang tidak benar, penentuan titik akhir yang subjektif, kesalahan pengukuran buret, atau kesalahan dalam pengulangan titrasi.
Dengan memahami prinsip kerja titrasi dan mengikuti langkah-langkah yang telah dijelaskan, Anda akan dapat melakukan titrasi dengan akurat dan mendapatkan hasil yang dapat diandalkan. Penting untuk menjadi teliti dan hati-hati dalam setiap langkah titrasi untuk meminimalkan kesalahan. Selamat mencoba dan semoga sukses dalam melakukan analisis kimia menggunakan titrasi!
