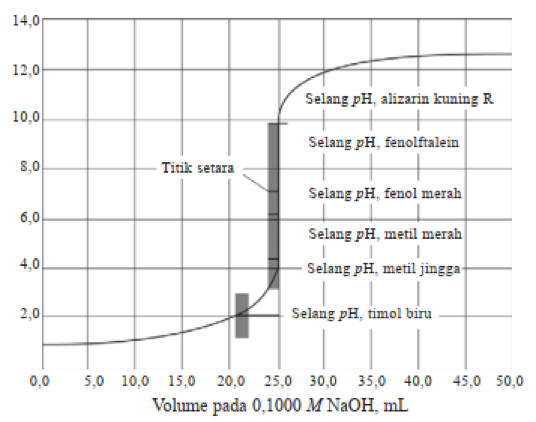
Titik ekivalen titrasi adalah titik di mana jumlah zat yang dititrasi secara kimia sama dengan jumlah zat penitrasi yang ditambahkan. Dalam titrasi, titik ekivalen menandakan bahwa reaksi antara zat yang dititrasi dan penitrasi telah mencapai kesetimbangan stoikiometri. Titik ekivalen ini menjadi sangat penting dalam analisis kuantitatif, karena dapat digunakan untuk menghitung kadar zat yang dititrasi.
Sebagai contoh, dalam titrasi asam-basa, titik ekivalen adalah titik di mana jumlah asam yang dititrasi sama dengan jumlah basa yang ditambahkan. Pada titik ini, semua asam akan bereaksi dengan basa dalam perbandingan stoikiometri yang tepat. Sedangkan dalam titrasi oksidasi-reduksi, titik ekivalen adalah titik di mana jumlah oksidator yang dititrasi sama dengan jumlah reduktor yang ditambahkan.
Untuk menghitung titik ekivalen titrasi, diperlukan beberapa informasi seperti jenis reaksi yang terjadi, konsentrasi zat yang dititrasi dan penitrasi, serta volume penitrasi yang ditambahkan. Metode yang umum digunakan adalah dengan mengamati perubahan warna yang terjadi saat mencapai titik ekivalen. Fenomena ini dikenal sebagai indikator titrasi, di mana indikator yang digunakan akan berubah warna saat titik ekivalen tercapai.
Pengertian Titik Ekivalen Titrasi
Pada bagian ini, akan dijelaskan secara detail pengertian dan konsep dasar tentang titik ekivalen titrasi. Kami akan menjelaskan mengapa titik ekivalen penting dalam analisis kuantitatif dan bagaimana cara menghitungnya.
Titik ekivalen titrasi merupakan titik di mana jumlah zat yang dititrasi secara kimia sama dengan jumlah zat penitrasi yang ditambahkan. Dalam titrasi, titik ekivalen menandakan bahwa reaksi antara zat yang dititrasi dan penitrasi telah mencapai kesetimbangan stoikiometri. Dalam titrasi asam-basa, titik ekivalen adalah titik di mana jumlah asam yang dititrasi sama dengan jumlah basa yang ditambahkan. Pada titik ini, semua asam akan bereaksi dengan basa dalam perbandingan stoikiometri yang tepat. Sedangkan dalam titrasi oksidasi-reduksi, titik ekivalen adalah titik di mana jumlah oksidator yang dititrasi sama dengan jumlah reduktor yang ditambahkan.
Titik ekivalen sangat penting dalam analisis kuantitatif, karena dapat digunakan untuk menghitung kadar zat yang dititrasi. Dengan mengetahui volume penitrasi yang ditambahkan pada titik ekivalen, kita dapat menghitung kadar zat yang dititrasi berdasarkan perbandingan stoikiometri yang telah ditentukan. Misalnya, jika kita mengetahui bahwa dalam titrasi asam-basa, setiap mol asam bereaksi dengan satu mol basa, maka dengan mengetahui volume basa yang ditambahkan pada titik ekivalen, kita dapat menghitung jumlah mol asam yang dititrasi dan akhirnya menghitung kadar asam tersebut.
Kenapa Titik Ekivalen Penting dalam Analisis Kuantitatif?
Titik ekivalen titrasi menjadi sangat penting dalam analisis kuantitatif karena memberikan informasi tentang jumlah zat yang dititrasi. Dalam analisis kuantitatif, penting untuk mengetahui kadar zat tertentu dalam sebuah sampel. Dengan mengetahui volume penitrasi yang ditambahkan pada titik ekivalen, kita dapat menghitung jumlah zat yang dititrasi berdasarkan perbandingan stoikiometri yang telah ditentukan. Hal ini memungkinkan kita untuk menghitung kadar zat tersebut dalam sampel dengan akurasi yang tinggi.
Sebagai contoh, jika kita ingin mengetahui kadar asam asetat dalam sebuah larutan, kita dapat melakukan titrasi dengan menggunakan larutan basa natrium hidroksida (NaOH) dengan konsentrasi yang diketahui. Dalam titrasi ini, ketika titik ekivalen tercapai, berarti jumlah asam asetat yang dititrasi sama dengan jumlah basa natrium hidroksida yang ditambahkan. Dengan mengetahui volume basa natrium hidroksida yang ditambahkan pada titik ekivalen, kita dapat menghitung jumlah mol asam asetat yang dititrasi dan akhirnya menghitung kadar asam asetat dalam larutan tersebut.
Cara Menghitung Titik Ekivalen Titrasi
Untuk menghitung titik ekivalen titrasi, diperlukan beberapa informasi seperti jenis reaksi yang terjadi, konsentrasi zat yang dititrasi dan penitrasi, serta volume penitrasi yang ditambahkan. Metode yang umum digunakan adalah dengan mengamati perubahan warna yang terjadi saat mencapai titik ekivalen. Fenomena ini dikenal sebagai indikator titrasi, di mana indikator yang digunakan akan berubah warna saat titik ekivalen tercapai.
Pertama-tama, kita perlu menentukan jenis reaksi yang terjadi dalam titrasi. Misalnya, jika kita melakukan titrasi asam-basa, kita perlu mengetahui reaksi antara asam dan basa yang terlibat. Dalam hal ini, kita juga perlu mengetahui perbandingan stoikiometri antara asam dan basa untuk menghitung jumlah mol zat yang dititrasi pada titik ekivalen.
Setelah mengetahui jenis reaksi dan perbandingan stoikiometri, kita perlu menentukan konsentrasi zat yang dititrasi dan penitrasi. Konsentrasi ini akan digunakan dalam perhitungan untuk menentukan jumlah mol zat yang dititrasi dan penitrasi.
Selanjutnya, kita perlu menentukan volume penitrasi yang ditambahkan. Volume ini akan terus ditambahkan hingga mencapai titik ekivalen. Pada titik ekivalen, jumlah zat yang dititrasi dan penitrasi akan sama, dan itulah yang akan digunakan untuk menghitung kadar zat yang dititrasi.
Metode yang umum digunakan untuk menentukan titik ekivalen adalah dengan menggunakan indikator titrasi. Indikator adalah senyawa yang berubah warna saat titik ekivalen tercapai. Dalam titrasi asam-basa, contohnya adalah fenolftalein yang berubah warna dari tak berwarna menjadi merah muda saat mencapai titik ekivalen. Dengan menggunakan indikator, kita dapat mengamati perubahan warna ini sebagai petunjuk bahwa titik ekivalen telah tercapai.
Jenis-jenis Titik Ekivalen Titrasi
Di sini, akan dibahas berbagai jenis titik ekivalen yang mungkin terjadi dalam titrasi, seperti titik ekivalen asam-basa, titik ekivalen oksidasi-reduksi, dan lain-lain. Setiap jenis titik ekivalen memiliki karakteristik dan perhitungan yang berbeda.
Titik Ekivalen Asam-Basa
Titik ekivalen asam-basa adalah titik di mana jumlah asam yang dititrasi sama dengan jumlah basa yang ditambahkan. Pada titik ini, semua asam akan bereaksi dengan basa dalam perbandingan stoikiometri yang tepat. Untuk menghitung titik ekivalen asam-basa, kita perlu mengetahui jenis asam dan basa yang terlibat dalam titrasi, serta perbandingan stoikiometri antara keduanya. Dalam titrasi asam-basa, indikator yang umum digunakan adalah fenolftalein. Indikator ini akan berubah warna dari tak berwarna menjadi merah muda saat mencapai titik ekivalen.
Titik Ekivalen Oksidasi-Reduksi
Titik ekivalen oksidasi-reduksi adalah titik di mana jumlah oksidator yang dititrasi sama dengan jumlah reduktor yang ditambahkan. Pada titik ini, semua oksidator akan bereaksidengan reduktor dalam perbandingan stoikiometri yang tepat. Untuk menghitung titik ekivalen oksidasi-reduksi, kita perlu mengetahui jenis oksidator dan reduktor yang terlibat dalam titrasi, serta perbandingan stoikiometri antara keduanya. Dalam titrasi oksidasi-reduksi, indikator yang umum digunakan adalah larutan tiosulfat natrium, yang akan mengalami perubahan warna saat titik ekivalen tercapai.
Titik Ekivalen Presipitasi
Titik ekivalen presipitasi adalah titik di mana terbentuk presipitat yang larutannya tidak larut di dalam larutan penitrasi. Pada titik ini, semua zat yang akan membentuk presipitat akan bereaksi dalam perbandingan stoikiometri yang tepat. Untuk menghitung titik ekivalen presipitasi, kita perlu mengetahui jenis zat yang akan membentuk presipitat, serta perbandingan stoikiometri antara zat tersebut. Dalam titrasi presipitasi, indikator yang umum digunakan adalah indikator kompleksometri, yang akan mengalami perubahan warna saat terbentuk presipitat pada titik ekivalen.
Indikator Titrasi: Fungsi dan Jenis-jenisnya
Indikator titrasi adalah senyawa yang digunakan untuk menunjukkan titik ekivalen dalam sebuah titrasi. Indikator ini berfungsi untuk memberikan sinyal visual atau perubahan warna saat titik ekivalen tercapai. Dalam titrasi asam-basa, indikator titrasi akan berubah warna pada rentang pH tertentu, yang sesuai dengan titik ekivalen asam-basa. Berikut adalah beberapa jenis indikator titrasi yang umum digunakan:
Fenolftalein
Fenolftalein adalah indikator titrasi yang paling umum digunakan dalam titrasi asam-basa. Pada pH rendah (< 8), fenolftalein berwarna tak berwarna, tetapi saat pH meningkat di atas 8, indikator ini berubah warna menjadi merah muda. Fenolftalein sering digunakan dalam titrasi asam-basa dengan penambahan larutan basa natrium hidroksida.
Litmus
Litmus adalah indikator titrasi alami yang berasal dari tumbuhan. Litmus berwarna merah dalam larutan asam dan biru dalam larutan basa. Litmus tidak memberikan perubahan warna yang tajam pada titik ekivalen, tetapi tetap digunakan dalam titrasi sebagai indikator sederhana.
Metil Jingga
Metil jingga adalah indikator titrasi yang berwarna oranye kemerahan di dalam larutan asam dan kuning di dalam larutan basa. Indikator ini sering digunakan dalam titrasi asam-basa dengan penambahan larutan basa natrium hidroksida.
Metil Oranye
Metil oranye adalah indikator titrasi yang berwarna merah di dalam larutan asam dan kuning di dalam larutan basa. Indikator ini sering digunakan dalam titrasi asam-basa dengan penambahan larutan basa natrium hidroksida.
Indikator Kompleksometri
Indikator kompleksometri adalah indikator yang membentuk kompleks dengan ion logam dalam larutan. Perubahan warna terjadi saat kompleks terbentuk atau terlarut. Indikator kompleksometri sering digunakan dalam titrasi presipitasi, di mana titik ekivalen ditandai dengan terbentuknya presipitat atau larutan yang terlarut. Contoh indikator kompleksometri yang umum digunakan adalah indikator eriochrome black T.
Metode Penentuan Titik Ekivalen Titrasi
Ada beberapa metode yang dapat digunakan untuk menentukan titik ekivalen titrasi, tergantung pada jenis titrasi yang dilakukan dan kondisi eksperimen yang tersedia. Berikut adalah beberapa metode umum yang digunakan dalam penentuan titik ekivalen titrasi:
Metode Potensiometri
Metode potensiometri melibatkan pengukuran potensial listrik di antara elektroda yang terendam dalam larutan titrasi. Pada titik ekivalen, terjadi perubahan potensial yang tajam. Metode ini sering digunakan dalam titrasi asam-basa dengan menggunakan elektroda pH sebagai indikator potensiometri.
Metode Spektrofotometri
Metode spektrofotometri melibatkan pengukuran absorbansi atau transmisi cahaya pada panjang gelombang tertentu. Pada titik ekivalen, terjadi perubahan absorbansi yang tajam. Metode ini sering digunakan dalam titrasi dengan menggunakan indikator yang berubah warna saat mencapai titik ekivalen.
Metode Konduktometri
Metode konduktometri melibatkan pengukuran konduktivitas listrik dalam larutan titrasi. Pada titik ekivalen, terjadi perubahan konduktivitas yang tajam. Metode ini sering digunakan dalam titrasi asam-basa dengan menggunakan elektroda konduktometri sebagai indikator.
Metode Titik Akhir Titrasi
Metode titik akhir titrasi adalah metode yang mengandalkan perubahan warna atau perubahan sifat fisis yang terlihat saat mencapai titik ekivalen. Metode ini sering menggunakan indikator titrasi untuk memberikan perubahan warna saat mencapai titik ekivalen. Misalnya, dalam titrasi asam-basa, perubahan warna indikator fenolftalein dari tak berwarna menjadi merah muda menandakan titik ekivalen.
Faktor-faktor yang Mempengaruhi Titik Ekivalen Titrasi
Terdapat beberapa faktor yang dapat mempengaruhi titik ekivalen titrasi, dan penting untuk memperhatikan faktor-faktor ini agar titrasi dapat dilakukan dengan akurasi yang tinggi. Berikut adalah beberapa faktor yang perlu diperhatikan dalam titrasi:
Konsentrasi Zat yang Dititrasi dan Penitrasi
Konsentrasi zat yang dititrasi dan penitrasi akan mempengaruhi jumlah mol zat yang bereaksi pada titik ekivalen. Semakin tinggi konsentrasi zat yang dititrasi, semakin banyak mol zat yang bereaksi. Oleh karena itu, penting untuk mengukur konsentrasi zat dengan akurat sebelum melakukan titrasi.
Jenis Reaksi yang Terlibat
Jenis reaksi yang terlibat dalam titrasi juga dapat mempengaruhi titik ekivalen. Setiap reaksi memiliki perbandingan stoikiometri yang berbeda, sehingga akan mempengaruhi jumlah penitrasi yang diperlukan untuk mencapai titik ekivalen. Penting untuk mengetahui jenis reaksi yang terlibat dan perbandingan stoikiometri yang tepat.
Keberadaan Zat Lain dalam Larutan
Keberadaan zat lain dalam larutan dapat mempengaruhi titik ekivalen. Misalnya, jika ada zat yang dapat mengadsorpsi indikator, hal ini dapat menyebabkan perubahan warna indikator terhambat atau tidak terjadi sama sekali. Oleh karena itu, penting untuk memperhatikan keberadaan zat lain dalam larutan dan memperhatikan interaksi yang mungkin terjadi.
Suhu
Suhu juga dapat mempengaruhi titik ekivalen, terutama jika reaksi yang terlibat dalam titrasi termasuk reaksi yang endotermik atau eksotermik. Perubahan suhu dapat mempengaruhi laju reaksi dan keseimbangan reaksi, yang pada gilirannya akan mempengaruhi titik ekivalen. Oleh karena itu, penting untuk menjaga suhu konstan selama titrasi dan mempertimbangkan efek suhu dalam perhitungan titik ekivalen.
Contoh Soal dan Pembahasan Mengenai Titik Ekivalen Titrasi
Untuk memperjelas pemahaman mengenai titik ekivalen titrasi, akan diberikan beberapa contoh soal beserta pembahasannya. Setiap contoh soal akan menunjukkan langkah-langkah perhitungan yang harus dilakukan untuk mencari titik ekivalen dalam titrasi tertentu.
Contoh Soal 1: Titrasi Asam Sulfat dengan Natrium Hidroksida
Sebuah larutan asam sulfat dengan konsentrasi 0,1 M dititrasi dengan larutan natrium hidroksida 0,2 M. Berapa volume larutan natrium hidroksida yang diperlukan untuk mencapai titik ekivalen?
Langkah-langkah:
- Tentukan perbandingan stoikiometri antara asam sulfat dan natrium hidroksida. Dalam reaksi ini, setiap mol asam sulfat bereaksi dengan dua mol natrium hidroksida.
- Tentukan jumlah mol asam sulfat yang dititrasi. Jumlah mol dapat dihitung dengan mengalikan konsentrasi dengan volume asam sulfat yang digunakan.
- Tentukan jumlah mol natrium hidroksida yang diperlukan. Jumlah mol natrium hidroksida harus sama dengan jumlah mol asam sulfat yang dititrasi.
- Tentukan volume larutan natrium hidroksida yang diperlukan. Volume dapat dihitung dengan membagi jumlah mol natrium hidroksida dengan konsentrasi larutan.
Jawaban:
- Perbandingan stoikiometri antara asam sulfat dan natrium hidroksida adalah 1:2.
- Jumlah mol asam sulfat yang dititrasi = 0,1 M x volume asam sulfat (dalam L).
- Jumlah mol natrium hidroksida yang diperlukan = jumlah mol asam sulfat yang dititrasi.
- Volume larutan natrium hidroksida yang diperlukan = jumlah mol natrium hidroksida / konsentrasi larutan.
Contoh Soal 2: Titrasi Kalium Permanganat dengan Besi(II) Sulfat
Sebuah larutan kalium permanganat dengan konsentrasi 0,02 M dititrasi dengan larutan besi(II) sulfat 0,04 M. Berapa volume larutan besi(II) sulfat yang diperlukan untuk mencapai titik ekivalen?
Langkah-langkah:
- Tentukan perbandingan stoikiometri antara kalium permanganat dan besi(II) sulfat. Dalam reaksi ini, setiap mol kalium permanganat bereaksi dengan lima mol besi(II) sulfat.
- Tentukan jumlah mol kalium permanganat yang dititrasi. Jumlah mol dapat dihitung dengan mengalikan konsentrasi dengan volume kalium permanganat yang digunakan.
- Tentukan jumlah mol besi(II) sulfat yang diperlukan. Jumlah mol besi(II) sulfat harus sama dengan jumlah mol kalium permanganat yang dititrasi.
- Tentukan volume larutan besi(II) sulfat yang diperlukan. Volume dapat dihitung dengan membagi jumlah mol besi(II) sulfat dengan konsentrasi larutan.
Jawaban:
- Perbandingan stoikiometri antara kalium permanganat dan besi(II) sulfat adalah 1:5.
- Jumlah mol kalium permanganat yang dititrasi = 0,02 M x volume kalium permanganat (dalam L).
- Jumlah mol besi(II) sulfat yang diperlukan = jumlah mol kalium permanganat yang dititrasi.
- Volume larutan besi(II) sulfat yang diperlukan = jumlah mol besi(II) sulfat / konsentrasi larutan.
Aplikasi Titik Ekivalen Titrasi dalam Kehidupan Sehari-hari
Tidak hanya digunakan dalam bidang analisis kimia, titik ekivalen titrasi juga memiliki aplikasi dalam kehidupan sehari-hari. Berikut adalah beberapa contoh penggunaan titik ekivalen titrasi dalam berbagai industri dan kegiatan sehari-hari:
Pembuatan Obat
Dalam industri farmasi, titik ekivalen titrasi digunakan dalam pembuatan obat-obatan. Dalam proses produksi obat, titrasi digunakan untuk mengukur kadar bahan aktif dalam obat. Dengan menentukan titik ekivalen, produsen dapat memastikan bahwa obat yang diproduksi memiliki konsentrasi bahan aktif yang sesuai dengan yang diinginkan.
Pengolahan Makanan
Titrasi juga digunakan dalam industri pengolahan makanan untuk mengukur kadar bahan kimia yang diperlukan dalam proses produksi. Misalnya, dalam pembuatan saus tomat, titrasi dapat digunakan untuk mengukur kadar asam sitrat yang diperlukan untuk menjaga tingkat keasaman yang tepat dalam saus.
Pemurnian Air
Titrasi juga digunakan dalam pemurnian air untuk mengukur kadar zat-zat yang tidak diinginkan, seperti klorin. Dengan menentukan titik ekivalen, dapat ditentukan jumlah bahan kimia yang diperlukan untuk menghilangkan klorin dari air dengan akurat.
Pembuatan Minuman
Titrasi digunakan dalam industri minuman untuk mengukur kadar alkohol dalam minuman beralkohol. Dalam proses pembuatan minuman beralkohol, titrasi dapat digunakan untuk memastikan bahwa kadar alkohol dalam minuman sesuai dengan yang diinginkan.
Kelebihan dan Keterbatasan Metode Titik Ekivalen Titrasi
Metode titik ekivalen titrasi memiliki kelebihan dan keterbatasan masing-masing. Dalam penggunaannya, penting untuk mempertimbangkan kelebihan dan keterbatasan tersebut agar titrasi dapat dilakukan dengan akurasi yang tinggi. Berikut adalah beberapa kelebihan dan keterbatasan metode titik ekivalen titrasi:
Kelebihan Metode Titik Ekivalen Titrasi
- Metode titik ekivalen titrasi relatif sederhana dan cepat dalam melakukan analisis kuantitatif.
- Metode ini dapat digunakan untuk mengukur kadar zat-zat yang sulit diukur dengan metode analisis lainnya.
- Metode titik ekivalen titrasi dapat digunakan untuk berbagai jenis reaksi, seperti asam-basa, oksidasi-reduksi, dan presipitasi.
Keterbatasan Metode Titik Ekivalen Titrasi
- Metode ini membutuhkan persiapan yang cermat dan ketelitian dalam pengukuran volume larutan dan konsentrasi zat.
- Metode titik ekivalen titrasi tidak dapat digunakan jika tidak ada indikator yang cocok atau jika perubahan warna indikator tidak terlihat dengan jelas.
- Metode ini tidak efektif jika ada zat-zat yang mengganggu dalam larutan, seperti zat-zat yang mengadsorpsi indikator atau zat-zat yang membentuk presipitat.
Perbandingan Antara Titik Ekivalen dan Titik Akhir Titrasi
Banyak orang sering bingung antara titik ekivalen dan titik akhir titrasi. Meskipun kedua istilah tersebut sering digunakan secara bergantian, sebenarnya memiliki perbedaanyang penting dalam analisis titrasi. Berikut adalah perbedaan antara kedua istilah tersebut:
Titik Ekivalen
Titik ekivalen adalah titik di mana jumlah zat yang dititrasi secara kimia sama dengan jumlah zat penitrasi yang ditambahkan. Titik ekivalen menandakan bahwa reaksi antara zat yang dititrasi dan penitrasi telah mencapai kesetimbangan stoikiometri. Pada titik ini, semua zat yang dititrasi telah bereaksi dalam perbandingan yang tepat dengan zat penitrasi. Titik ekivalen dapat ditentukan dengan menggunakan metode seperti perubahan warna indikator atau perubahan sifat fisik lainnya.
Titik Akhir
Titik akhir titrasi adalah titik di mana perubahan yang diamati, seperti perubahan warna indikator, mengindikasikan bahwa titrasi telah mencapai titik ekivalen. Titik akhir ditentukan oleh perubahan yang terlihat secara visual atau melalui perangkat pengukuran, seperti spektrofotometer atau pH meter. Titik akhir ini tidak selalu sama dengan titik ekivalen, tetapi biasanya merupakan perkiraan yang cukup akurat.
Perbedaan utama antara titik ekivalen dan titik akhir adalah bahwa titik ekivalen adalah titik di mana reaksi mencapai kesetimbangan stoikiometri, sementara titik akhir adalah titik di mana perubahan yang diamati menunjukkan bahwa titrasi telah mencapai titik ekivalen. Dalam beberapa kasus, titik akhir dapat sedikit berbeda dari titik ekivalen, terutama jika ada faktor-faktor yang mempengaruhi perubahan warna indikator atau perubahan sifat fisik lainnya.
Kesimpulan
Titik ekivalen titrasi adalah titik di mana jumlah zat yang dititrasi secara kimia sama dengan jumlah zat penitrasi yang ditambahkan. Titik ekivalen ini penting dalam analisis kuantitatif karena dapat digunakan untuk menghitung kadar zat yang dititrasi. Untuk menghitung titik ekivalen, diperlukan informasi tentang jenis reaksi, konsentrasi zat, dan volume penitrasi. Metode yang umum digunakan adalah dengan menggunakan indikator titrasi yang mengalami perubahan warna saat mencapai titik ekivalen.
Ada berbagai jenis titik ekivalen yang mungkin terjadi dalam titrasi, seperti titik ekivalen asam-basa, titik ekivalen oksidasi-reduksi, dan titik ekivalen presipitasi. Setiap jenis titik ekivalen memiliki karakteristik dan perhitungan yang berbeda. Indikator titrasi digunakan untuk menunjukkan titik ekivalen dalam titrasi, dan ada berbagai jenis indikator yang dapat digunakan, seperti fenolftalein, litmus, dan indikator kompleksometri.
Metode yang digunakan untuk menentukan titik ekivalen titrasi meliputi metode potensiometri, spektrofotometri, konduktometri, dan metode titik akhir. Faktor-faktor seperti konsentrasi zat, jenis reaksi, keberadaan zat lain dalam larutan, dan suhu dapat mempengaruhi titik ekivalen.
Titik ekivalen titrasi memiliki berbagai aplikasi dalam kehidupan sehari-hari, seperti dalam pembuatan obat, pengolahan makanan, pemurnian air, dan pembuatan minuman. Metode titik ekivalen titrasi memiliki kelebihan seperti sederhana dan cepat dalam melakukan analisis kuantitatif, tetapi juga memiliki keterbatasan seperti persiapan yang cermat dan ketergantungan pada indikator yang cocok.
Perbedaan antara titik ekivalen dan titik akhir adalah bahwa titik ekivalen adalah titik di mana reaksi mencapai kesetimbangan stoikiometri, sedangkan titik akhir adalah titik di mana perubahan yang diamati menunjukkan bahwa titrasi telah mencapai titik ekivalen. Meskipun titik akhir mungkin tidak selalu sama dengan titik ekivalen, tetapi biasanya merupakan perkiraan yang cukup akurat.
