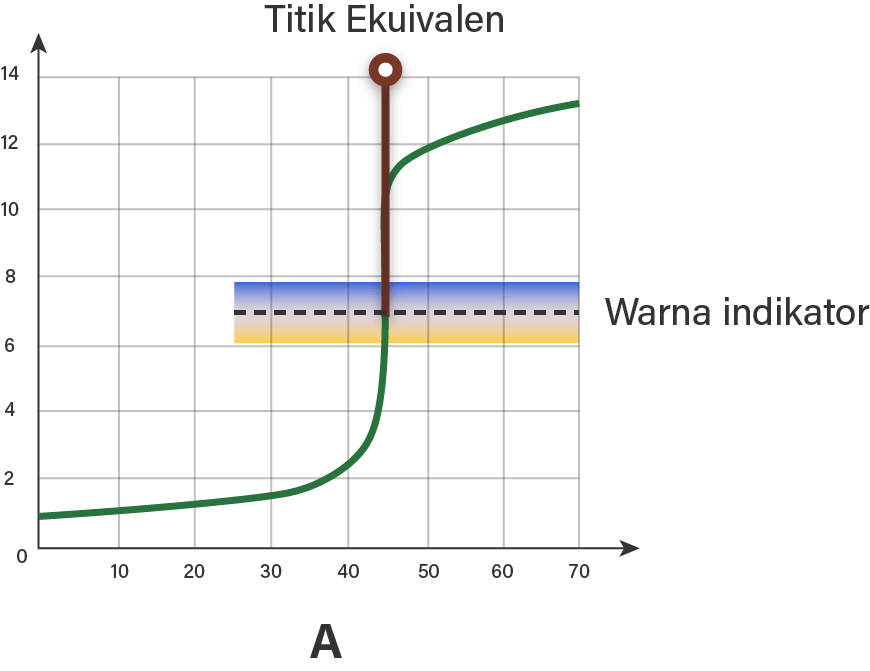
Titik ekivalen adalah istilah yang sering digunakan dalam kimia analitik untuk menggambarkan titik di mana reaksi kimia mencapai kesetimbangan. Dalam analisis titrasi, titik ekivalen menunjukkan jumlah stoikiometri yang tepat antara zat yang dititrasi dan zat pengindikator. Pemahaman yang baik tentang konsep ini penting dalam menginterpretasikan hasil analisis dan membuat keputusan yang tepat dalam laboratorium.
Dalam artikel ini, kita akan membahas secara rinci tentang titik ekivalen. Pertama-tama, kita akan menggali pengertian dari titik ekivalen dan mengapa hal ini penting dalam analisis titrasi. Selanjutnya, kita akan menjelaskan fungsi titik ekivalen dalam menentukan konsentrasi larutan yang tidak diketahui. Terakhir, kita akan membahas beberapa metode yang umum digunakan untuk menentukan titik ekivalen dalam laboratorium.
Pengertian Titik Ekivalen
Titik ekivalen adalah titik di mana jumlah stoikiometri yang tepat antara zat yang dititrasi dan zat pengindikator tercapai. Pada titik ini, reaksi kimia mencapai kesetimbangan dan perubahan warna yang nyata terjadi. Titik ekivalen sering digunakan dalam analisis titrasi untuk menentukan konsentrasi larutan yang tidak diketahui berdasarkan reaksi dengan larutan standar yang diketahui.
Titik ekivalen dapat dilihat sebagai titik di mana zat yang dititrasi dan zat pengindikator bereaksi dalam rasio stoikiometri yang tepat. Dalam analisis titrasi, zat yang dititrasi adalah zat yang konsentrasinya ingin diketahui, sedangkan zat pengindikator adalah zat yang berubah warna ketika titik ekivalen tercapai. Ketika titik ekivalen tercapai, jumlah mol zat yang dititrasi dan zat pengindikator sama, sehingga perubahan warna yang nyata terjadi.
Titik ekivalen sangat penting dalam analisis titrasi karena titik ini memberikan informasi tentang jumlah stoikiometri yang tepat antara zat yang dititrasi dan zat pengindikator. Dalam analisis titrasi, kita dapat menggunakan persamaan reaksi dan volume larutan standar yang diperlukan untuk mencapai titik ekivalen untuk menghitung konsentrasi larutan yang tidak diketahui. Oleh karena itu, pemahaman yang baik tentang titik ekivalen sangat penting dalam menginterpretasikan hasil analisis dan membuat keputusan yang tepat dalam laboratorium.
Fungsi Titik Ekivalen dalam Analisis Titrasi
Titik ekivalen memiliki peran penting dalam analisis titrasi. Saat mencapai titik ekivalen, jumlah stoikiometri yang tepat antara zat yang dititrasi dan zat pengindikator menunjukkan bahwa reaksi kimia telah selesai. Perubahan warna yang terjadi pada titik ini juga memberikan indikasi visual yang jelas bahwa titrasi telah mencapai titik akhir.
Mengukur Konsentrasi Larutan
Salah satu fungsi utama titik ekivalen dalam analisis titrasi adalah untuk mengukur konsentrasi larutan yang tidak diketahui. Dalam analisis titrasi, kita menggunakan larutan standar yang diketahui konsentrasinya untuk menitrasi larutan yang tidak diketahui. Dengan mengetahui volume larutan standar yang diperlukan untuk mencapai titik ekivalen, kita dapat menggunakan persamaan reaksi dan prinsip kesetimbangan kimia untuk menghitung konsentrasi larutan yang tidak diketahui.
Misalnya, dalam titrasi asam-basa, kita dapat menggunakan larutan standar basa yang diketahui konsentrasinya untuk menitrasi larutan asam yang tidak diketahui konsentrasinya. Dengan mengetahui volume larutan basa yang diperlukan untuk mencapai titik ekivalen, kita dapat menghitung konsentrasi asam yang tidak diketahui berdasarkan persamaan reaksi dan prinsip kesetimbangan kimia.
Determinasi Reaksi Kimia
Titik ekivalen juga digunakan untuk menentukan reaksi kimia yang terjadi dalam analisis titrasi. Dalam analisis titrasi, kita menggunakan larutan standar yang diketahui konsentrasinya untuk bereaksi dengan larutan yang tidak diketahui. Ketika titik ekivalen tercapai, kita dapat mengetahui jumlah stoikiometri yang tepat antara zat yang dititrasi dan zat pengindikator, yang memberikan petunjuk tentang reaksi kimia yang terjadi.
Sebagai contoh, dalam titrasi asam-basa, ketika titik ekivalen tercapai, kita dapat mengetahui bahwa jumlah stoikiometri antara asam dan basa adalah 1:1. Hal ini mengindikasikan bahwa reaksi kimia yang terjadi adalah reaksi netralisasi, di mana asam dan basa bereaksi untuk menghasilkan garam dan air. Dengan mengetahui reaksi kimia yang terjadi, kita dapat memahami lebih lanjut tentang sifat dan karakteristik larutan yang dititrasi.
Metode Penentuan Titik Ekivalen
Ada beberapa metode yang umum digunakan untuk menentukan titik ekivalen dalam analisis titrasi. Metode-metode ini melibatkan penggunaan indikator, elektroda, atau metode instrumen seperti spektrofotometri. Beberapa metode umum termasuk titrasi asam-basa, titrasi kompleksometri, titrasi oksidasi-reduksi, dan titrasi pengendapan.
Titrasi Asam-Basa
Titrasi asam-basa adalah metode yang paling umum digunakan untuk menentukan titik ekivalen. Dalam titrasi ini, indikator pH digunakan untuk menunjukkan titik akhir titrasi. Indikator pH adalah senyawa organik yang berubah warna ketika pH larutan berubah. Pada titik ekivalen, pH larutan berubah secara drastis, yang menandakan bahwa reaksi asam-basa telah selesai.
Beberapa contoh indikator pH yang umum digunakan dalam titrasi asam-basa adalah fenolftalein, metil jingga, dan bromtimol biru. Fenolftalein berubah warna dari tak berwarna menjadi merah muda pada pH larutan tinggi (alkalis). Metil jingga berubah warna dari merah muda menjadi kuning pada pH larutan rendah (asam). Bromtimol biru berubah warna dari kuning menjadi biru pada pH larutan tinggi (alkalis).
Titrasi Kompleksometri
Titrasi kompleksometri digunakan untuk menentukan titik ekivalen dalam kompleksometri, di mana kompleks logam membentuk senyawa kompleks dengan ligan. Dalam titrasi ini, larutan standar yang mengandung logam kompleks diketahui konsentrasinya digunakan untuk menitrasi larutan yang mengandung ligan. Ketika titik ekivalen tercapai, kompleks logam-ligan bereaksi dalam rasio stoikiometri yang tepat.
Salah satu contoh titrasi kompleksometri yang umum dilakukan adalah titrasi dengan menggunakan larutan standar yang mengandung EDTA (etilenediaminetetraasetat) sebagai kompleks logam. EDTA merupakan ligan yang berikatan dengan logam untuk membentuk senyawa kompleks yang stabil. Ketika titik ekivalen tercapai, jumlah stoikiometri yang tepat antara EDTA dan logam tercapai, dan perubahan warna yang nyata terjadi.
Titrasi Oksidasi-Reduksi
Titrasi oksidasi-reduksi melibatkan reaksi oksidasi dan reduksi, dan digunakan untuk menentukan titik ekivalen dalam reaksi redoks. Dalam titrasi ini, larutan standar yang mengandung oksidator atau reduktordigunakan untuk menitrasi larutan yang mengandung zat yang akan ditentukan konsentrasinya. Ketika titik ekivalen tercapai, reaksi oksidasi-reduksi antara zat yang dititrasi dan zat standar mencapai stoikiometri yang tepat.
Contoh umum titrasi oksidasi-reduksi adalah titrasi iodometri, di mana larutan standar yang mengandung iodin digunakan sebagai zat oksidator. Ketika iodin bereaksi dengan zat yang dititrasi, seperti tiosulfat, terjadi reaksi reduksi. Pada titik ekivalen, jumlah stoikiometri yang tepat antara iodin dan tiosulfat tercapai, dan terjadi perubahan warna yang nyata.
Titrasi Pengendapan
Titrasi pengendapan melibatkan reaksi pengendapan untuk menentukan titik ekivalen. Dalam titrasi ini, larutan standar yang mengandung pengendap digunakan untuk menitrasi larutan yang mengandung zat yang akan ditentukan konsentrasinya. Ketika titik ekivalen tercapai, zat yang dititrasi bereaksi dengan pengendap dalam jumlah stoikiometri yang tepat, dan terjadi pengendapan yang nyata.
Contoh umum titrasi pengendapan adalah titrasi dengan menggunakan larutan standar yang mengandung perak nitrat (AgNO3) sebagai pengendap. Ketika perak nitrat bereaksi dengan zat yang dititrasi, seperti klorida, terjadi reaksi pengendapan dan terbentuk endapan perak klorida (AgCl). Pada titik ekivalen, jumlah stoikiometri yang tepat antara perak nitrat dan klorida tercapai, dan terjadi perubahan warna atau pembentukan endapan yang nyata.
Kesimpulan
Dalam artikel ini, kita telah membahas secara rinci tentang titik ekivalen dalam analisis titrasi. Titik ekivalen adalah titik di mana reaksi kimia mencapai kesetimbangan dan jumlah stoikiometri yang tepat antara zat yang dititrasi dan zat pengindikator tercapai. Titik ekivalen memiliki fungsi penting dalam menentukan konsentrasi larutan yang tidak diketahui dalam analisis titrasi.
Beberapa metode yang umum digunakan untuk menentukan titik ekivalen termasuk titrasi asam-basa, titrasi kompleksometri, titrasi oksidasi-reduksi, dan titrasi pengendapan. Setiap metode memiliki prinsip kerja yang berbeda tergantung pada jenis reaksi yang terlibat. Dalam setiap metode, penting untuk memilih indikator atau pengendap yang tepat untuk memastikan deteksi titik ekivalen yang akurat.
Dengan pemahaman yang baik tentang titik ekivalen dan metode penentuannya, kita dapat melakukan analisis titrasi dengan lebih akurat dan menghasilkan hasil yang dapat diandalkan dalam laboratorium. Pemilihan metode yang tepat dan interpretasi yang benar terhadap perubahan warna atau pembentukan endapan pada titik ekivalen akan membantu kita mendapatkan informasi yang akurat tentang konsentrasi larutan yang tidak diketahui dan reaksi kimia yang terjadi.
Sebagai penutup, pemahaman tentang titik ekivalen dapat memperkaya pengetahuan kita dalam bidang kimia analitik. Dalam melakukan analisis titrasi, titik ekivalen menjadi titik krusial yang menunjukkan selesainya reaksi kimia dan memberikan petunjuk tentang konsentrasi larutan yang tidak diketahui. Dengan menguasai konsep ini, kita dapat menjadi lebih terampil dalam melakukan analisis laboratorium dan menghasilkan data yang akurat dan berguna dalam berbagai bidang ilmu dan industri.
