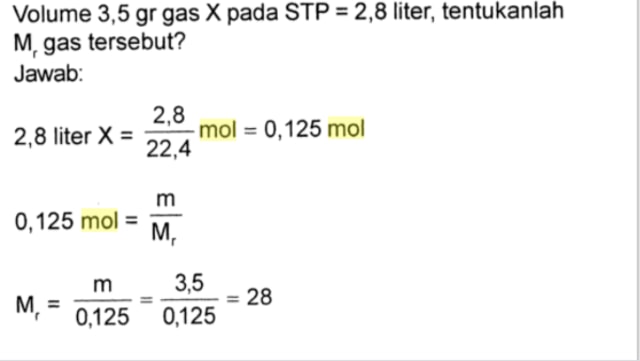
Soal konsep mol adalah topik yang penting dalam pembelajaran kimia. Konsep ini berkaitan dengan pengukuran dan penghitungan jumlah partikel dalam sebuah zat. Untuk memahami konsep mol dengan baik, diperlukan pemahaman yang mendalam dan penerapan yang tepat.
Dalam artikel ini, kita akan menjelajahi konsep mol dengan rinci dan komprehensif. Mulai dari pengertian dasar hingga contoh soal yang dapat membantu Anda memperdalam pemahaman Anda. Mari kita mulai dengan mempelajari pengertian dasar tentang mol.
Pengertian Mol
Mol adalah satuan pengukuran yang digunakan dalam kimia untuk menggambarkan jumlah partikel dalam sebuah zat. Konsep mol didasarkan pada teori Avogadro yang menyatakan bahwa volume yang sama dari gas pada kondisi yang sama mengandung jumlah partikel yang sama. Dalam hal ini, satu mol zat mengandung jumlah partikel yang sama dengan jumlah atom di dalam 12 gram karbon-12.
Satuan Mol
Satuan mol dilambangkan dengan simbol "mol" dan digunakan untuk mengukur jumlah partikel dalam sebuah zat. Satu mol setara dengan jumlah partikel Avogadro (6,022 x 10^23). Jadi, jika Anda memiliki satu mol zat, Anda memiliki 6,022 x 10^23 partikel zat tersebut.
Pentingnya Konsep Mol
Konsep mol sangat penting dalam kimia karena memungkinkan kita untuk menghubungkan jumlah partikel dengan massa zat. Dengan menggunakan konsep mol, kita dapat menghitung massa zat berdasarkan jumlah partikel atau sebaliknya. Selain itu, konsep mol juga digunakan dalam perhitungan stoikiometri reaksi, yaitu hubungan antara jumlah partikel dalam reaksi kimia.
Konsep Avogadro
Konsep Avogadro merupakan dasar dari konsep mol. Konsep ini menyatakan bahwa volume yang sama dari gas pada kondisi yang sama mengandung jumlah partikel yang sama, yang dikenal sebagai jumlah Avogadro. Jumlah Avogadro adalah 6,022 x 10^23 partikel per mol.
Bilangan Avogadro
Bilangan Avogadro (NA) adalah konstanta yang digunakan untuk menghubungkan jumlah partikel dengan jumlah mol. Bilangan Avogadro dinyatakan sebagai 6,022 x 10^23 partikel per mol. Dengan menggunakan bilangan Avogadro, kita dapat mengkonversi antara jumlah partikel dan jumlah mol.
Penggunaan Bilangan Avogadro
Bilangan Avogadro digunakan dalam berbagai perhitungan kimia. Misalnya, untuk menghitung jumlah partikel dalam sebuah zat, kita dapat mengalikan jumlah mol dengan bilangan Avogadro. Sebaliknya, jika kita memiliki jumlah partikel, kita dapat mengkonversikannya menjadi jumlah mol dengan membaginya dengan bilangan Avogadro.
Perhitungan Mol
Perhitungan mol adalah kunci untuk memahami dan mengaplikasikan konsep mol secara efektif. Dalam perhitungan mol, kita menggunakan rumus-rumus dan konsep-konsep yang berkaitan dengan jumlah partikel dan massa zat.
Langkah-langkah Perhitungan Mol
Perhitungan mol melibatkan beberapa langkah yang harus diikuti. Berikut adalah langkah-langkah umum yang dapat Anda terapkan dalam perhitungan mol:
- Tentukan zat yang ingin Anda hitung jumlah molnya.
- Tentukan massa zat tersebut (dalam gram).
- Hitung massa molar zat tersebut dengan menggunakan rumus massa molar = massa zat / jumlah mol.
- Hitung jumlah mol dengan membagi massa zat dengan massa molar.
- Gunakan bilangan Avogadro untuk mengkonversi jumlah mol menjadi jumlah partikel.
Contoh Perhitungan Mol
Untuk memahami perhitungan mol dengan lebih baik, mari kita lihat contoh perhitungan mol berikut:
Contoh 1: Berapa jumlah mol karbon dioksida (CO2) dalam 44 gram CO2?
Langkah 1: Tentukan zat yang ingin Anda hitung jumlah molnya. Dalam contoh ini, zatnya adalah CO2.
Langkah 2: Tentukan massa CO2 (dalam gram). Massa CO2 adalah 44 gram.
Langkah 3: Hitung massa molar CO2. Massa molar CO2 = 44 gram / 1 mol = 44 gram/mol.
Langkah 4: Hitung jumlah mol CO2. Jumlah mol CO2 = massa CO2 / massa molar CO2 = 44 gram / 44 gram/mol = 1 mol.
Langkah 5: Gunakan bilangan Avogadro untuk mengkonversi jumlah mol menjadi jumlah partikel. Jumlah partikel CO2 = 1 mol x 6,022 x 10^23 partikel/mol = 6,022 x 10^23 partikel.
Contoh 2: Berapa jumlah partikel dalam 0,5 mol air (H2O)?
Langkah 1: Tentukan zat yang ingin Anda hitung jumlah partikelnya. Dalam contoh ini, zatnya adalah H2O.
Langkah 2: Tentukan jumlah mol H2O. Jumlah mol H2O adalah 0,5 mol.
Langkah 3: Gunakan bilangan Avogadro untuk mengkonversi jumlah mol menjadi jumlah partikel. Jumlah partikel H2O = 0,5 mol x 6,022 x 10^23 partikel/mol = 3,011 x 10^23 partikel.
Konversi Massa ke Mol
Konversi massa ke mol adalah salah satu konsep penting yang terkait dengan konsep mol. Dalam konversi ini, kita mengubah massa zat menjadi jumlah mol menggunakan massa molar zat tersebut.
Massa Molar
Massa molar adalah massa suatu zat per mol zat tersebut. Massa molar dinyatakan dalam gram/mol. Untuk menghitung massa molar, kita perlu mengetahui massa atom masing-masing unsur yang membentuk zat tersebut.
Langkah-langkah Konversi Massa ke Mol
Berikut adalah langkah-langkah untuk mengkonversi massa ke mol:
- Tentukan massa zat yang ingin Anda konversi (dalam gram).
- Hitung massa molar zat tersebut.
- Bagi massa zat dengan massa molar untuk mendapatkan jumlah mol.
Contoh Konversi Massa ke Mol
Untuk memahami konversi massa ke mol dengan lebih baik, mari kita lihat contoh konversi massa ke mol berikut:
Contoh 1: Konversi 60 gram natrium (Na) menjadi jumlah mol.
Langkah 1: Tentukan massa natrium (Na) yang ingin Anda konversi. Massa natrium adalah 60 gram.
Langkah 2: Hitung massa molar natrium (Na). Massa molar natrium = 23 gram/mol.
Langkah 3: Bagi massa natrium dengan massa molar. Jumlah mol natrium = 60 gram / 23 gram/mol = 2,61 mol.
Contoh 2: Konversi 100 gram air (H2O) menjadi jumlah mol.
Langkah 1: Tentukan massa air (H2O) yang ingin Anda konversi. Massa air adalah 100 gram.
Langkah 2: Hitung massa molar air (H2O). Massa molar air = 18 gram/mol.
Langkah 3: Bagi massa air dengan massa molar. Jumlah mol air = 100 gram / 18 gram/mol = 5,56 mol.
Konversi Mol ke Partikel
Konversi mol ke partikel adalah konsep yang penting dalam konsep mol. Dalam konversi ini, kita mengubah jumlah mol menjadi jumlah partikel menggunakan bilangan Av
Konversi Mol ke Partikel (lanjutan)
Konversi mol ke partikel adalah konsep yang penting dalam konsep mol. Dalam konversi ini, kita mengubah jumlah mol menjadi jumlah partikel menggunakan bilangan Avogadro.
Konstanta Gas Ideal
Untuk mengkonversi jumlah mol menjadi jumlah partikel, kita perlu menggunakan konstanta gas ideal. Konstanta gas ideal (R) adalah konstanta yang digunakan dalam persamaan gas ideal untuk menghubungkan tekanan, volume, suhu, dan jumlah mol gas.
Langkah-langkah Konversi Mol ke Partikel
Berikut adalah langkah-langkah untuk mengkonversi mol ke partikel:
- Tentukan jumlah mol yang ingin Anda konversi.
- Gunakan bilangan Avogadro (6,022 x 10^23 partikel/mol) untuk mengkonversi jumlah mol menjadi jumlah partikel.
Contoh Konversi Mol ke Partikel
Untuk memahami konversi mol ke partikel dengan lebih baik, mari kita lihat contoh konversi mol ke partikel berikut:
Contoh 1: Konversi 2 mol hidrogen (H2) menjadi jumlah partikel.
Langkah 1: Tentukan jumlah mol hidrogen (H2) yang ingin Anda konversi. Jumlah mol hidrogen adalah 2 mol.
Langkah 2: Gunakan bilangan Avogadro untuk mengkonversi jumlah mol menjadi jumlah partikel. Jumlah partikel hidrogen = 2 mol x 6,022 x 10^23 partikel/mol = 1,2044 x 10^24 partikel.
Contoh 2: Konversi 0,5 mol amonia (NH3) menjadi jumlah partikel.
Langkah 1: Tentukan jumlah mol amonia (NH3) yang ingin Anda konversi. Jumlah mol amonia adalah 0,5 mol.
Langkah 2: Gunakan bilangan Avogadro untuk mengkonversi jumlah mol menjadi jumlah partikel. Jumlah partikel amonia = 0,5 mol x 6,022 x 10^23 partikel/mol = 3,011 x 10^23 partikel.
Konsep Mol dalam Reaksi Kimia
Konsep mol dalam reaksi kimia berhubungan dengan perhitungan stoikiometri reaksi, yaitu hubungan antara jumlah partikel dalam reaksi kimia. Dalam perhitungan stoikiometri, kita menggunakan koefisien reaksi untuk menghubungkan jumlah mol zat yang terlibat dalam reaksi.
Langkah-langkah Perhitungan Stoikiometri Reaksi
Berikut adalah langkah-langkah umum untuk melakukan perhitungan stoikiometri reaksi:
- Tentukan reaksi kimia yang ingin Anda analisis.
- Tentukan koefisien reaksi yang sesuai untuk setiap zat dalam persamaan reaksi.
- Hitung jumlah mol zat yang diketahui.
- Gunakan koefisien reaksi untuk menghitung jumlah mol zat lain yang terlibat dalam reaksi.
- Gunakan konsep mol untuk mengkonversi jumlah mol menjadi jumlah partikel atau massa zat.
Contoh Perhitungan Stoikiometri Reaksi
Untuk memahami perhitungan stoikiometri reaksi dengan lebih baik, mari kita lihat contoh perhitungan stoikiometri reaksi berikut:
Contoh 1: Dalam reaksi pembakaran metana (CH4), berapa jumlah mol karbon dioksida (CO2) yang dihasilkan jika 2 mol metana terbakar?
Langkah 1: Tentukan reaksi kimia yang ingin Anda analisis. Dalam contoh ini, reaksi yang ingin kita analisis adalah pembakaran metana (CH4).
Langkah 2: Tentukan koefisien reaksi yang sesuai. Dalam reaksi pembakaran metana, koefisien untuk metana (CH4) adalah 1 dan untuk karbon dioksida (CO2) adalah 1.
Langkah 3: Hitung jumlah mol metana yang diketahui. Jumlah mol metana adalah 2 mol.
Langkah 4: Gunakan koefisien reaksi untuk menghitung jumlah mol karbon dioksida. Jumlah mol karbon dioksida = jumlah mol metana x koefisien CO2 / koefisien CH4 = 2 mol x 1/1 = 2 mol.
Langkah 5: Gunakan konsep mol untuk mengkonversi jumlah mol menjadi jumlah partikel atau massa zat jika diperlukan.
Contoh 2: Dalam reaksi kimia, 4 mol besi (Fe) bereaksi dengan 3 mol belerang (S) untuk menghasilkan besi sulfida (FeS). Berapa jumlah mol besi sulfida yang dihasilkan?
Langkah 1: Tentukan reaksi kimia yang ingin Anda analisis. Dalam contoh ini, reaksi yang ingin kita analisis adalah reaksi antara besi (Fe) dan belerang (S) untuk menghasilkan besi sulfida (FeS).
Langkah 2: Tentukan koefisien reaksi yang sesuai. Dalam reaksi ini, koefisien untuk besi (Fe) adalah 4, belerang (S) adalah 3, dan besi sulfida (FeS) adalah 4.
Langkah 3: Hitung jumlah mol besi yang diketahui. Jumlah mol besi adalah 4 mol.
Langkah 4: Gunakan koefisien reaksi untuk menghitung jumlah mol besi sulfida. Jumlah mol besi sulfida = jumlah mol besi x koefisien FeS / koefisien Fe = 4 mol x 4/4 = 4 mol.
Langkah 5: Gunakan konsep mol untuk mengkonversi jumlah mol menjadi jumlah partikel atau massa zat jika diperlukan.
Konsep Mol dalam Larutan
Konsep mol juga digunakan dalam larutan untuk menggambarkan konsentrasi zat dalam larutan. Konsentrasi mol adalah jumlah mol zat terlarut yang terkandung dalam satu liter larutan.
Konsentrasi Mol
Konsentrasi mol dinyatakan sebagai jumlah mol zat terlarut per liter larutan. Konsentrasi mol dapat digunakan untuk menghitung jumlah partikel zat terlarut dalam larutan.
Langkah-langkah Menghitung Konsentrasi Mol
Berikut adalah langkah-langkah untuk menghitung konsentrasi mol:
- Tentukan jumlah mol zat terlarut yang ingin Anda hitung.
- Tentukan volume larutan dalam liter.
- Bagi jumlah mol zat terlarut dengan volume larutan untuk mendapatkan konsentrasi mol.
Contoh Menghitung Konsentrasi Mol
Untuk memahami perhitungan konsentrasi mol dengan lebih baik, mari kita lihat contoh menghitung konsentrasi mol berikut:
Contoh 1: Berapa konsentrasi mol natrium klorida (NaCl) dalam larutan jika terdapat 0,5 mol NaCl dalam 1 liter larutan?
Langkah 1: Tentukan jumlah mol natrium klorida (NaCl) yang ingin Anda hitung. Jumlah mol NaCl adalah 0,5 mol.
Langkah 2: Tentukan volume larutan dalam liter. Volume larutan adalah 1 liter.
Langkah 3: Bagi jumlah mol NaCl dengan volume larutan. Konsentrasi mol NaCl = 0,5 mol / 1 liter = 0,5 mol/L.
Contoh 2: Berapa konsentrasi mol asam sulfat (H2SO4) dalam larutan jika terdapat 2 mol H2SO4 dalam 500 mL larutan?
Langkah 1: Tentukan jumlah mol asam sulfat (H2SO4) yang ingin Anda hitung. Jumlah mol H2SO4 adalah 2 mol.
Langkah 2: Tentukan volume larutan dalam liter. Volume larutan adalah 500 mL = 0,5 liter
Langkah 3: Bagi jumlah mol H2SO4 dengan volume larutan. Konsentrasi mol H2SO4 = 2 mol / 0,5 liter = 4 mol/L.
Konsep Mol dalam Gas
Konsep mol juga berperan penting dalam memahami sifat dan perilaku gas. Dalam gas, konsep mol digunakan untuk menghubungkan volume, tekanan, suhu, dan jumlah partikel gas.
Hukum Gas Ideal
Hukum gas ideal adalah hukum yang menggambarkan hubungan antara tekanan, volume, suhu, dan jumlah mol gas. Hukum gas ideal dirumuskan dalam persamaan gas ideal: PV = nRT, di mana P adalah tekanan, V adalah volume, n adalah jumlah mol gas, R adalah konstanta gas ideal, dan T adalah suhu dalam Kelvin.
Langkah-langkah Menghitung Jumlah Mol Gas
Berikut adalah langkah-langkah untuk menghitung jumlah mol gas menggunakan hukum gas ideal:
- Tentukan tekanan gas (dalam atm), volume gas (dalam liter), suhu gas (dalam Kelvin), dan konstanta gas ideal (R).
- Gunakan persamaan gas ideal (PV = nRT) untuk menghitung jumlah mol gas (n).
Contoh Menghitung Jumlah Mol Gas
Untuk memahami perhitungan jumlah mol gas dengan lebih baik, mari kita lihat contoh menghitung jumlah mol gas berikut:
Contoh 1: Berapa jumlah mol gas nitrogen (N2) dalam sebuah wadah dengan tekanan 2 atm, volume 5 liter, dan suhu 298 K?
Langkah 1: Tentukan tekanan gas (P), volume gas (V), suhu gas (T), dan konstanta gas ideal (R). P = 2 atm, V = 5 liter, T = 298 K, dan R = 0,0821 L.atm/mol.K.
Langkah 2: Gunakan persamaan gas ideal (PV = nRT) untuk menghitung jumlah mol gas (n). n = PV / RT = (2 atm) x (5 liter) / (0,0821 L.atm/mol.K x 298 K) = 0,338 mol.
Contoh 2: Berapa jumlah mol gas oksigen (O2) dalam sebuah wadah dengan tekanan 3 atm, volume 2 liter, dan suhu 273 K?
Langkah 1: Tentukan tekanan gas (P), volume gas (V), suhu gas (T), dan konstanta gas ideal (R). P = 3 atm, V = 2 liter, T = 273 K, dan R = 0,0821 L.atm/mol.K.
Langkah 2: Gunakan persamaan gas ideal (PV = nRT) untuk menghitung jumlah mol gas (n). n = PV / RT = (3 atm) x (2 liter) / (0,0821 L.atm/mol.K x 273 K) = 0,219 mol.
Contoh Soal Konsep Mol
Setelah mempelajari konsep mol dengan rinci, sekarang saatnya untuk melihat beberapa contoh soal konsep mol beserta penyelesaiannya. Contoh soal ini akan membantu Anda melatih keterampilan perhitungan mol dan menguji pemahaman Anda tentang konsep ini.
Contoh Soal 1
Seberapa banyak partikel yang terdapat dalam 2 mol hidrogen (H2)?
Langkah 1: Tentukan jumlah mol hidrogen yang ingin Anda hitung partikelnya. Jumlah mol hidrogen adalah 2 mol.
Langkah 2: Gunakan bilangan Avogadro untuk mengkonversi jumlah mol menjadi jumlah partikel. Jumlah partikel hidrogen = 2 mol x 6,022 x 10^23 partikel/mol = 1,2044 x 10^24 partikel.
Contoh Soal 2
Berapa jumlah mol air (H2O) dalam 36 gram H2O?
Langkah 1: Tentukan massa air (H2O) yang ingin Anda hitung jumlah molnya. Massa air adalah 36 gram.
Langkah 2: Hitung massa molar air (H2O). Massa molar air = 18 gram/mol.
Langkah 3: Bagi massa air dengan massa molar. Jumlah mol air = 36 gram / 18 gram/mol = 2 mol.
Contoh Soal 3
Berapa jumlah partikel dalam 0,5 mol karbon monoksida (CO)?
Langkah 1: Tentukan jumlah mol karbon monoksida yang ingin Anda hitung partikelnya. Jumlah mol karbon monoksida adalah 0,5 mol.
Langkah 2: Gunakan bilangan Avogadro untuk mengkonversi jumlah mol menjadi jumlah partikel. Jumlah partikel karbon monoksida = 0,5 mol x 6,022 x 10^23 partikel/mol = 3,011 x 10^23 partikel.
Kesimpulan
Dalam artikel ini, kita telah menjelajahi konsep mol dengan rinci dan komprehensif. Kita telah mempelajari pengertian dasar tentang mol, konsep Avogadro, perhitungan mol, konversi massa ke mol, konversi mol ke partikel, konsep mol dalam reaksi kimia, konsep mol dalam larutan, dan konsep mol dalam gas.
Konsep mol sangat penting dalam kimia karena memungkinkan kita untuk menghubungkan jumlah partikel dengan massa zat. Dengan menggunakan konsep mol, kita dapat melakukan perhitungan mol, konversi massa ke mol, konversi mol ke partikel, dan perhitungan stoikiometri reaksi dengan lebih efektif.
Dalam memahami konsep mol, penting untuk memahami penggunaan bilangan Avogadro, massa molar, konstanta gas ideal, dan persamaan gas ideal. Dengan memahami konsep-konsep ini, kita dapat mengaplikasikan konsep mol dalam berbagai situasi dan perhitungan kimia.
Dengan membaca artikel ini dan melatih keterampilan perhitungan mol, diharapkan Anda akan memiliki pemahaman yang lebih baik tentang konsep mol dan mampu mengaplikasikannya dengan tepat dalam studi kimia Anda.
