Rangkuman kimia unsur adalah artikel yang memberikan gambaran menyeluruh tentang berbagai aspek penting yang berkaitan dengan unsur-unsur kimia. Dalam artikel ini, kita akan menjelajahi dunia kimia unsur dengan tujuan memberikan pemahaman yang lebih baik mengenai sifat-sifat, struktur, dan kegunaan unsur-unsur ini.
Pengenalan Unsur Kimia
Pengenalan unsur kimia merupakan langkah awal dalam memahami dunia kimia. Unsur kimia adalah zat murni yang tidak dapat diuraikan menjadi zat yang lebih sederhana melalui reaksi kimia. Mereka terdiri dari atom dengan jumlah proton yang sama di inti atom. Proton ini menentukan identitas unsur dan jumlahnya disebut nomor atom. Tabel periodik merupakan cara kita mengelompokkan unsur-unsur berdasarkan nomor atom mereka.
Tabel periodik terdiri dari baris horizontal yang disebut periode dan kolom vertikal yang disebut golongan. Setiap periode memiliki jumlah lapisan elektron yang berbeda, sedangkan setiap golongan memiliki jumlah elektron valensi yang sama. Elektron valensi adalah elektron yang berada di lapisan terluar atom dan menentukan sifat kimia unsur.
Sejarah Unsur Kimia
Penemuan unsur-unsur kimia dimulai pada abad ke-18 dan ke-19. Pada tahun 1869, Dmitri Mendeleev memperkenalkan tabel periodik modern yang mengatur unsur-unsur berdasarkan massa atom. Penemuan ini memungkinkan para ilmuwan untuk memprediksi sifat-sifat unsur yang belum ditemukan pada waktu itu. Seiring berjalannya waktu, tabel periodik terus berkembang dengan penemuan unsur-unsur baru.
Klasifikasi Unsur Kimia
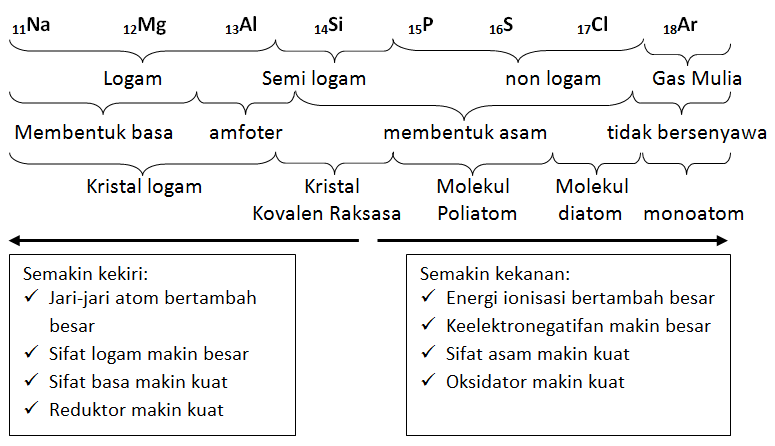
Unsur-unsur kimia dapat diklasifikasikan menjadi beberapa kelompok berdasarkan sifat-sifat kimianya. Kelompok utama termasuk logam, nonlogam, dan semilogam. Logam umumnya memiliki kilap, konduktivitas listrik dan panas yang tinggi, serta sifat lentur dan mudah ditempa. Nonlogam cenderung tidak berkilap, memiliki konduktivitas listrik dan panas yang rendah, dan cenderung rapuh. Semilogam memiliki sifat-sifat yang menengah antara logam dan nonlogam.
Kelompok lainnya dalam tabel periodik termasuk unsur-unsur alkali, alkali tanah, halogen, dan gas mulia. Unsur-unsur alkali seperti natrium dan kalium cenderung sangat reaktif dan mudah membentuk ion positif. Alkali tanah seperti magnesium dan kalsium juga reaktif, tetapi lebih stabil daripada unsur alkali. Halogen seperti klorin dan fluorin adalah nonlogam yang sangat reaktif dan cenderung membentuk ion negatif. Gas mulia seperti helium dan neon adalah unsur-unsur yang sangat stabil dan tidak reaktif.
Sifat Fisik Unsur Kimia
Sifat fisik unsur kimia mencakup berbagai parameter yang dapat diamati secara langsung. Berikut ini adalah beberapa sifat fisik yang umum diamati pada unsur-unsur kimia:
Massa Atom
Massa atom adalah massa relatif suatu unsur dibandingkan dengan massa karbon-12 yang dibulatkan ke bilangan bulat terdekat. Massa atom tidak memiliki satuan tetap, tetapi biasanya dinyatakan dalam satuan massa atom (u) atau dalton (Da).
Titik Lebur
Titik lebur adalah suhu pada tekanan atmosfer saat unsur berubah dari fase padat menjadi fase cair. Titik lebur bervariasi antara unsur-unsur kimia dan dapat dipengaruhi oleh faktor seperti ikatan kimia dan struktur kristal.
Titik Didih
Titik didih adalah suhu pada tekanan atmosfer saat unsur berubah dari fase cair menjadi fase gas. Seperti titik lebur, titik didih juga bervariasi antara unsur-unsur dan dipengaruhi oleh faktor-faktor tertentu.
Kepadatan
Kepadatan adalah massa per satuan volume suatu unsur. Kepadatan umumnya dinyatakan dalam gram per sentimeter kubik (g/cm³) atau kilogram per meter kubik (kg/m³).
Konduktivitas Termal dan Listrik
Konduktivitas termal adalah kemampuan suatu unsur untuk menghantarkan panas, sedangkan konduktivitas listrik adalah kemampuan unsur untuk menghantarkan listrik. Logam umumnya memiliki konduktivitas termal dan listrik yang tinggi, sedangkan nonlogam cenderung memiliki konduktivitas yang rendah.
Kerapatan
Kerapatan adalah perbandingan massa suatu unsur dengan volume yang diduduki oleh unsur tersebut. Kerapatan pada dasarnya menggambarkan seberapa padat suatu unsur tersebut. Unsur dengan kerapatan tinggi cenderung lebih berat dan lebih padat daripada unsur dengan kerapatan rendah.
Titik Didih
Titik didih adalah suhu pada tekanan atmosfer saat unsur berubah dari fase cair menjadi fase gas. Seperti titik lebur, titik didih juga bervariasi antara unsur-unsur dan dipengaruhi oleh faktor-faktor tertentu.
Konduktivitas Termal dan Listrik
Konduktivitas termal adalah kemampuan suatu unsur untuk menghantarkan panas, sedangkan konduktivitas listrik adalah kemampuan unsur untuk menghantarkan listrik. Logam umumnya memiliki konduktivitas termal dan listrik yang tinggi, sedangkan nonlogam cenderung memiliki konduktivitas yang rendah.
Kerapatan
Kerapatan adalah perbandingan massa suatu unsur dengan volume yang diduduki oleh unsur tersebut. Kerapatan pada dasarnya menggambarkan seberapa padat suatu unsur tersebut. Unsur dengan kerapatan tinggi cenderung lebih berat dan lebih padat daripada unsur dengan kerapatan rendah.
Sifat Kimia Unsur Kimia
Sifat kimia unsur kimia mencakup berbagai reaktivitas dan kemampuan unsur-unsur untuk membentuk senyawa dengan unsur lainnya. Berikut ini adalah beberapa sifat kimia yang umum diamati pada unsur-unsur kimia:
Reaktivitas
Reaktivitas adalah kemampuan suatu unsur untuk bereaksi dengan unsur lainnya. Beberapa unsur sangat reaktif dan mudah membentuk senyawa, sementara yang lain cenderung tidak reaktif. Reaktivitas unsur juga dapat dipengaruhi oleh kehadiran unsur lain, suhu, dan tekanan.
Elektronegativitas
Elektronegativitas adalah kemampuan suatu unsur untuk menarik elektron dalam ikatan kimia. Unsur dengan elektronegativitas tinggi cenderung menarik elektron dengan lebih kuat, sedangkan unsur dengan elektronegativitas rendah cenderung melepaskan elektron dengan lebih mudah. Perbedaan elektronegativitas antara unsur-unsur dalam suatu senyawa mempengaruhi polaritas ikatan kimia.
Keasaman dan Kebasaan
Keasaman dan kebasaan adalah kemampuan suatu unsur untuk menyerap atau melepaskan ion hidrogen (H+). Unsur yang dapat melepaskan H+ dalam larutan disebut asam, sedangkan unsur yang dapat menyerap H+ disebut basa. Skala pH digunakan untuk mengukur tingkat keasaman atau kebasaan suatu larutan.
Kemampuan Pembentukan Senyawa
Kemampuan pembentukan senyawa adalah kemampuan suatu unsur untuk membentuk ikatan kimia dengan unsur lainnya. Beberapa unsur memiliki kemampuan yang sangat baik untuk membent
Beberapa unsur memiliki kemampuan yang sangat baik untuk membentuk senyawa, sementara yang lain cenderung lebih sulit untuk membentuk ikatan kimia. Kemampuan pembentukan senyawa ini tergantung pada konfigurasi elektron unsur dan jumlah valensi yang dimiliki.
Reaksi Oksidasi-Reduksi
Reaksi oksidasi-reduksi adalah reaksi kimia di mana suatu unsur kehilangan elektron (teroksidasi) dan unsur lain mendapatkan elektron (direduksi). Unsur yang kehilangan elektron disebut agen reduktor, sedangkan unsur yang mendapatkan elektron disebut agen oksidator.
Reaksi dengan Air
Beberapa unsur dapat bereaksi dengan air untuk membentuk senyawa atau menghasilkan gas. Misalnya, logam alkali seperti natrium dan kalium sangat reaktif terhadap air dan dapat menghasilkan gas hidrogen. Sementara itu, beberapa nonlogam seperti klorin dapat bereaksi dengan air untuk membentuk asam.
Reaksi dengan Asam
Banyak unsur dapat bereaksi dengan asam untuk membentuk garam dan gas. Misalnya, logam alkali bereaksi dengan asam sulfat untuk membentuk garam sulfat dan gas hidrogen. Reaksi ini juga dikenal sebagai reaksi netralisasi karena asam dan basa saling mengimbangi.
Reaksi dengan Basa
Unsur-unsur juga dapat bereaksi dengan basa untuk membentuk garam dan air. Misalnya, logam alkali bereaksi dengan basa seperti hidroksida logam untuk membentuk garam dan air. Reaksi ini juga dikenal sebagai reaksi netralisasi karena asam dan basa saling mengimbangi.
Reaksi dengan Oksigen
Banyak unsur bereaksi dengan oksigen untuk membentuk senyawa oksida. Beberapa contoh termasuk pembentukan oksida logam seperti besi(III) oksida (Fe2O3) dan oksida nonlogam seperti karbon dioksida (CO2). Reaksi ini juga dikenal sebagai oksidasi.
Struktur Atom dan Konfigurasi Elektron
Struktur atom dan konfigurasi elektron unsur-unsur dalam tabel periodik sangat penting dalam memahami sifat-sifat kimia mereka. Setiap atom terdiri dari inti yang terdiri dari proton dan neutron, serta elektron yang mengelilingi inti dalam lapisan energi.
Model Bohr dan Model Kuantum
Model Bohr adalah model pertama yang menggambarkan struktur atom dengan elektron yang mengorbit pada lapisan energi tertentu. Namun, model ini memiliki keterbatasan dalam menjelaskan perilaku elektron yang lebih kompleks. Model kuantum, yang dikembangkan berdasarkan prinsip-prinsip mekanika kuantum, memberikan gambaran yang lebih akurat tentang struktur atom dan perilaku elektron.
Nomor Periode dan Golongan
Setiap unsur dalam tabel periodik ditempatkan dalam periode dan golongan tertentu. Nomor periode menunjukkan jumlah lapisan elektron dalam atom, sedangkan nomor golongan menunjukkan jumlah elektron valensi. Elektron valensi adalah elektron yang berada di lapisan terluar atom dan menentukan sifat kimia unsur.
Konfigurasi Elektron
Konfigurasi elektron adalah susunan elektron dalam atom. Konfigurasi ini ditentukan oleh prinsip Aufbau, aturan Hund, dan aturan eksklusi Pauli. Konfigurasi elektron memainkan peran penting dalam menentukan sifat-sifat kimia unsur, seperti reaktivitas dan kemampuan membentuk ikatan kimia.
Gugus Blok dalam Tabel Periodik
Tabel periodik terdiri dari tiga gugus blok utama, yaitu blok s, blok p, dan blok d. Blok s terdiri dari golongan 1 dan 2, serta helium, sedangkan blok p terdiri dari golongan 13 hingga 18. Blok d terdiri dari golongan transisi. Setiap blok memiliki karakteristik dan sifat-sifat khas yang membedakannya.
Logam, Nonlogam, dan Semilogam
Unsur-unsur dalam tabel periodik dapat diklasifikasikan menjadi tiga kelompok utama berdasarkan sifat-sifat kimianya: logam, nonlogam, dan semilogam.
Logam
Logam umumnya memiliki sifat-sifat yang khas, seperti kilap, konduktivitas listrik dan panas yang tinggi, serta sifat lentur dan mudah ditempa. Logam juga cenderung memiliki titik lebur dan titik didih yang tinggi. Beberapa contoh logam termasuk besi, natrium, dan tembaga.
Nonlogam
Nonlogam cenderung tidak berkilap, memiliki konduktivitas listrik dan panas yang rendah, dan cenderung rapuh. Mereka cenderung memiliki titik lebur dan titik didih yang lebih rendah daripada logam. Nonlogam dapat terjadi dalam berbagai bentuk, termasuk gas, cairan, dan padatan. Beberapa contoh nonlogam termasuk oksigen, nitrogen, dan karbon.
Semilogam
Semilogam memiliki sifat-sifat yang menengah antara logam dan nonlogam. Mereka memiliki kilap yang lebih rendah daripada logam, konduktivitas listrik dan panas yang lebih tinggi daripada nonlogam, serta sifat lentur yang lebih baik daripada nonlogam. Beberapa contoh semilogam termasuk silikon, germanium, dan antimon.
Unsur Golongan Utama
Unsur golongan utama adalah unsur-unsur yang terletak di blok s dan blok p dalam tabel periodik. Kelompok ini terdiri dari unsur-unsur alkali, alkali tanah, halogen, dan gas mulia.
Unsur Alkali
Unsur alkali terletak di golongan 1 dalam tabel periodik. Mereka memiliki satu elektron valensi dan cenderung sangat reaktif. Unsur alkali seperti natrium dan kalium sering ditemukan dalam senyawa ionik dan digunakan dalam berbagai aplikasi industri, termasuk pembuatan sabun dan baterai.
Unsur Alkali Tanah
Unsur alkali tanah terletak di golongan 2. Mereka memiliki dua elektron valensi dan juga reaktif, meskipun tidak seaktif unsur alkali. Unsur alkali tanah seperti kalsium dan magnesium digunakan dalam berbagai aplikasi, termasuk pembuatan logam, bahan bangunan, dan suplemen kalsium.
Unsur Halogen
Unsur halogen terletak di golongan 17. Mereka memiliki tujuh elektron valensi dan cenderung sangat reaktif. Unsur halogen seperti klorin dan fluorin sering digunakan sebagai desinfektan, bahan pemutih, dan dalam industri kimia lainnya.
Gas Mulia
Gas mulia terletak di golongan 18. Mereka memiliki delapan elektron valensi dan cenderung sangat stabil dan tidak reaktif. Gas mulia seperti helium dan neon digunakan dalam berbagai aplikasi, termasuk penyinaran neon dan pendingin superkonduktor.
Unsur Transisi
Unsur transisi adalah unsur-unsur yang terletak di blok d dalam tabel periodik. Mereka memiliki konfigurasi elektron yang khas dan sering memiliki sifat-sifat yang berbeda dari unsur golongan utama.
Sifat-sifat Unsur Transisi
Unsur transisi umumnya memiliki sifat-sifat seperti konduktivitas listrik dan panas yang tinggi, kekerasan, dan berbagai tingkat reaktivitas. Mereka juga cenderung membentuk senyawa kompleks dengan
Mereka juga cenderung membentuk senyawa kompleks dengan ligand dan memiliki berbagai warna pada senyawa mereka. Unsur transisi memiliki banyak kegunaan dalam industri, termasuk sebagai katalis dalam reaksi kimia, dalam pembuatan logam, dan dalam elektronik.
Unsur Lantanida dan Aktinida
Unsur lantanida dan aktinida terletak di blok f dalam tabel periodik. Mereka adalah unsur-unsur yang sering disebut sebagai "unsur langka" karena mereka jarang ditemukan dalam jumlah yang signifikan di kerak bumi.
Unsur Lantanida
Unsur lantanida terletak di periode ke-6 dan golongan 3 hingga 12 dalam blok f. Mereka memiliki konfigurasi elektron yang unik dan sering digunakan dalam pembuatan magnet, lampu fluoresen, dan dalam industri teknologi tinggi lainnya.
Unsur Aktinida
Unsur aktinida terletak di periode ke-7 dan golongan 3 hingga 12 dalam blok f. Mereka adalah unsur radioaktif dan banyak digunakan dalam penelitian nuklir dan aplikasi medis. Beberapa contoh unsur aktinida termasuk uranium, plutonium, dan amerisium.
Unsur Buatan dan Radioaktif
Beberapa unsur dalam tabel periodik adalah unsur buatan yang tidak ditemukan secara alami di alam. Unsur-unsur ini dibuat melalui reaksi nuklir di laboratorium.
Unsur Buatan
Unsur buatan termasuk unsur yang dibuat oleh manusia melalui reaksi nuklir. Beberapa contoh unsur buatan termasuk teknesium, amerisium, dan nihonium. Unsur buatan memiliki berbagai aplikasi dalam penelitian fisika dan kedokteran nuklir.
Unsur Radioaktif
Unsur radioaktif adalah unsur yang mengalami peluruhan radioaktif dan menghasilkan radiasi. Beberapa contoh unsur radioaktif termasuk uranium, radium, dan radon. Unsur radioaktif memiliki berbagai aplikasi dalam bidang energi nuklir, penelitian medis, dan pengujian bahan.
Kegunaan dan Aplikasi Unsur Kimia
Unsur kimia memiliki berbagai kegunaan dan aplikasi dalam kehidupan sehari-hari. Mereka digunakan dalam berbagai industri, teknologi, kedokteran, dan bidang lainnya.
Industri
Unsur kimia digunakan dalam berbagai industri, seperti industri logam, petrokimia, dan farmasi. Misalnya, logam seperti besi dan aluminium digunakan dalam pembuatan kendaraan dan konstruksi bangunan. Bahan kimia seperti asam sulfat dan amonia digunakan dalam proses produksi industri.
Teknologi
Unsur kimia memiliki peran penting dalam teknologi modern. Misalnya, unsur silikon digunakan dalam pembuatan chip semikonduktor dan perangkat elektronik. Unsur-unsur transisi digunakan dalam pembuatan baterai, magnet, dan layar plasma. Unsur radioaktif digunakan dalam bidang penelitian dan teknologi nuklir.
Kedokteran
Unsur kimia memiliki berbagai aplikasi dalam kedokteran. Misalnya, unsur-unsur radioaktif digunakan dalam diagnosis dan pengobatan penyakit kanker. Bahan kimia seperti obat-obatan dan bahan tambalan digunakan dalam pengobatan penyakit dan pemulihan luka. Unsur seperti kalsium dan fosfor digunakan dalam pembentukan tulang dan gigi.
Lingkungan
Unsur kimia juga memiliki peran penting dalam menjaga kelestarian lingkungan. Misalnya, unsur seperti seng dan besi digunakan dalam pengolahan air limbah dan pemurnian air minum. Bahan kimia seperti klorin digunakan dalam penyaringan air untuk membunuh mikroorganisme berbahaya. Unsur kimia juga digunakan dalam pengolahan limbah industri.
Kesimpulan
Rangkuman kimia unsur ini telah memberikan pemahaman yang lebih dalam tentang berbagai aspek penting yang berkaitan dengan unsur-unsur kimia. Dari pengenalan unsur kimia hingga sifat-sifat, struktur atom, dan kegunaan, artikel ini memberikan gambaran komprehensif tentang dunia menarik unsur-unsur kimia.
Unsur-unsur kimia memiliki peran yang sangat penting dalam berbagai bidang, termasuk ilmu pengetahuan, industri, dan kedokteran. Dengan pemahaman yang lebih baik tentang sifat-sifat dan kegunaan unsur-unsur ini, kita dapat mengaplikasikan pengetahuan ini untuk menciptakan inovasi dan kemajuan dalam berbagai bidang kehidupan.
Semoga artikel ini dapat menjadi sumber informasi yang berguna bagi pembaca yang tertarik untuk mempelajari lebih lanjut tentang kimia unsur. Unsur-unsur kimia adalah dasar dari materi dan dunia di sekitar kita, dan memahami mereka memberikan wawasan yang lebih dalam tentang keajaiban dunia kimia.
