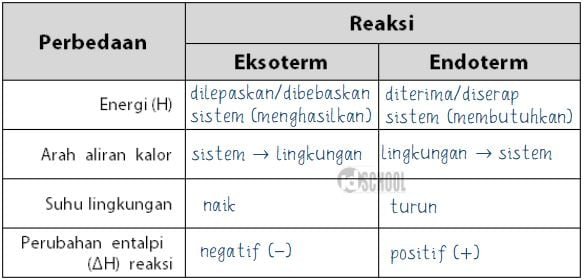
Perbedaan eksoterm dan endoterm adalah konsep penting dalam ilmu kimia yang mempelajari reaksi kimia dan perubahan energi yang terjadi selama proses tersebut. Dalam artikel ini, kita akan menjelajahi perbedaan antara kedua proses ini secara rinci dan komprehensif. Dengan pemahaman yang lebih dalam tentang eksoterm dan endoterm, kita dapat memahami bagaimana reaksi kimia bekerja dan bagaimana energi terlibat dalam proses tersebut.
Pengertian Eksoterm
Eksoterm adalah jenis reaksi kimia yang melepaskan energi dalam bentuk panas. Ketika reaksi eksoterm terjadi, energi kimia diubah menjadi energi panas dan dilepaskan ke lingkungan sekitarnya. Energi ini dapat digunakan untuk memanaskan lingkungan, melakukan kerja, atau menghasilkan cahaya. Salah satu contoh reaksi eksoterm yang umum adalah pembakaran kayu. Ketika kayu terbakar, energi kimia dalam kayu diubah menjadi energi panas dan cahaya yang dilepaskan ke lingkungan sekitarnya.
Proses Reaksi Eksoterm
Proses reaksi eksoterm dimulai dengan adanya reaktan, yaitu zat-zat yang akan bereaksi. Ketika reaktan bereaksi, ikatan antara atom-atom dalam molekul reaktan pecah dan ikatan baru terbentuk untuk membentuk produk baru. Selama proses ini, energi kimia dalam reaktan dilepaskan dan menghasilkan energi panas yang dapat dirasakan sebagai peningkatan suhu. Reaksi eksoterm dapat berlangsung dengan sendirinya tanpa memerlukan tambahan energi eksternal, karena energi yang dihasilkan cukup untuk mempertahankan reaksi tersebut.
Contoh Reaksi Eksoterm
Contoh lain dari reaksi eksoterm adalah reaksi pembusukan bahan organik. Ketika bahan organik seperti makanan atau tumbuhan mati, proses pembusukan terjadi. Selama proses ini, mikroorganisme menguraikan bahan organik menjadi zat-zat yang lebih sederhana. Selama proses penguraian ini, energi kimia dalam bahan organik dilepaskan dalam bentuk panas. Inilah sebabnya mengapa bahan organik yang membusuk sering terasa hangat.
Pengertian Endoterm
Endoterm adalah jenis reaksi kimia yang menyerap energi panas dari lingkungan sekitarnya. Ketika reaksi endoterm terjadi, energi panas dari lingkungan diubah menjadi energi kimia dalam reaktan. Salah satu contoh reaksi endoterm yang umum adalah penguapan air. Ketika air dipanaskan, energi panas dari sumber panas di sekitarnya diserap oleh air untuk mengubahnya menjadi uap air.
Proses Reaksi Endoterm
Proses reaksi endoterm dimulai dengan adanya reaktan yang membutuhkan energi untuk menghasilkan produk. Pada awal reaksi, energi panas dari lingkungan sekitarnya diserap oleh reaktan, dan ikatan antara atom-atom dalam reaktan pecah. Selama proses ini, energi kimia dalam reaktan meningkat dan membentuk produk baru. Reaksi endoterm membutuhkan tambahan energi eksternal untuk mempertahankan reaksi tersebut, karena energi yang tersedia tidak cukup untuk menjaga reaksi berjalan sendiri.
Contoh Reaksi Endoterm
Contoh reaksi endoterm adalah proses pendinginan air dengan menggunakan es. Ketika es ditempatkan dalam air, energi panas dari air diserap oleh es untuk mengubahnya menjadi air dingin. Proses ini membutuhkan energi panas dari lingkungan sekitarnya untuk mempertahankan suhu rendah pada es dan air dingin.
Perbedaan dalam Pelepasan dan Penyerapan Panas
Perbedaan utama antara eksoterm dan endoterm terletak pada pelepasan dan penyerapan panas. Pada reaksi eksoterm, energi panas dilepaskan dan suhu sistem meningkat. Sementara itu, pada reaksi endoterm, energi panas diserap dan suhu sistem menurun.
Pelepasan Energi Panas pada Eksoterm
Pada reaksi eksoterm, energi kimia dalam reaktan diubah menjadi energi panas dan dilepaskan ke lingkungan sekitarnya. Proses ini menyebabkan peningkatan suhu dalam sistem. Energi panas yang dilepaskan dapat dirasakan sebagai peningkatan suhu atau sebagai cahaya yang dihasilkan selama reaksi.
Penyerapan Energi Panas pada Endoterm
Pada reaksi endoterm, energi panas dari lingkungan sekitarnya diserap oleh reaktan untuk menghasilkan produk baru. Proses ini menyebabkan penurunan suhu dalam sistem. Energi panas yang diserap dapat dirasakan sebagai penurunan suhu atau sebagai perubahan fisik, seperti perubahan wujud zat dari padat menjadi cair atau gas.
Energi Aktivasi
Energi aktivasi adalah energi yang diperlukan agar suatu reaksi kimia dapat dimulai. Pada reaksi eksoterm, energi aktivasi cenderung lebih rendah dibandingkan dengan reaksi endoterm. Hal ini berarti reaksi eksoterm lebih mudah terjadi dibandingkan dengan reaksi endoterm.
Pengertian Energi Aktivasi
Energi aktivasi adalah energi minimum yang diperlukan agar ikatan-ikatan kimia dalam reaktan dapat pecah dan reaksi terjadi. Pada reaksi eksoterm, energi aktivasi lebih rendah karena energi panas yang dilepaskan selama reaksi membantu mengurangi energi yang diperlukan untuk memulai reaksi. Sebaliknya, pada reaksi endoterm, energi aktivasi lebih tinggi karena energi panas dari lingkungan harus diserap oleh reaktan untuk mencapai energi yang diperlukan.
Pengaruh Energi Aktivasi pada Kecepatan Reaksi
Energi aktivasi juga mempengaruhi kecepatan reaksi. Pada reaksi eksoterm dengan energi aktivasi yang rendah, lebih banyak molekul reaktan memiliki energi yang mencukupi untuk bergerak dan berinteraksi satu sama lain, sehingga reaksi berlangsung lebih cepat. Sementara itu, pada reaksi endoterm dengan energi aktivasi yang tinggi, molekul reaktan memerlukan tambahan energi untuk melewati hambatan energi aktivasi, sehingga reaksi berlangsung lebih lambat.
Pengaruh Suhu Terhadap Reaksi
Suhu memiliki pengaruh yang signifikan terhadap kecepatan reaksi. Perubahan suhu dapat mempengaruhi jumlah energi kinetik molekul-molekul reaktan dan energi yang diperlukan untuk melewati energi aktivasi. Pada reaksi eksoterm, suhu yang lebih tinggi cenderung meningkatkan energi kinetik molekul-molekul reaktan, sehingga meningkatkan kecepatan reaksi. Sementara itu, pada reaksi endoterm, suhu yang lebih tinggi cenderung meningkatkan energi yang diperlukan untuk melewati hambatan energi aktivasi, sehingga meningkatkan peluang terjadinya reaksi.
Pengaruh Suhu pada Laju Reaksi Eksoterm
Pada reaksi eksoterm, peningkatan suhu biasanya meningkatkan laju reaksi. Hal ini karena suhu yang lebih tinggi meningkatkan energi kinetik molekul-molekul reaktan, sehingga mereka bergerak lebih cepat dan berinteraksi satu sama lain dengan lebih sering. Lebih banyak tumbukan yang berhasil dan lebih banyak energi panas yang dilepaskan, sehingga reaksi berlangsung lebih cepat.
Pengaruh Suhu pada Laju Reaksi EndotPengaruh Suhu pada Laju Reaksi Endoterm
Pada reaksi endoterm, peningkatan suhu cenderung meningkatkan peluang terjadinya reaksi. Meskipun suhu yang lebih tinggi meningkatkan energi yang diperlukan untuk melewati hambatan energi aktivasi, namun energi kinetik molekul-molekul reaktan juga meningkat. Hal ini menyebabkan molekul-molekul reaktan bergerak lebih cepat dan lebih sering berinteraksi, sehingga peluang terjadinya reaksi menjadi lebih tinggi.
Pengaruh Suhu pada Keseimbangan Reaksi
Keseimbangan reaksi juga dapat dipengaruhi oleh perbedaan eksoterm dan endoterm. Pada reaksi eksoterm, peningkatan suhu cenderung mendorong reaksi ke arah produk. Hal ini dikarenakan peningkatan suhu menyebabkan energi panas yang dilepaskan semakin besar, sehingga keseimbangan reaksi bergeser ke arah produk untuk menyeimbangkan energi yang dilepaskan. Sementara itu, pada reaksi endoterm, peningkatan suhu cenderung mendorong reaksi ke arah reaktan. Hal ini karena peningkatan suhu menyebabkan energi panas yang diserap semakin besar, sehingga keseimbangan reaksi bergeser ke arah reaktan untuk menyeimbangkan energi yang diserap.
Aplikasi dalam Kehidupan Sehari-hari
Pengetahuan tentang perbedaan eksoterm dan endoterm memiliki banyak aplikasi dalam kehidupan sehari-hari, terutama dalam industri dan teknologi. Contohnya adalah dalam proses produksi energi seperti pembangkit listrik tenaga nuklir atau pembakaran bahan bakar fosil. Reaksi kimia eksoterm, seperti pembakaran bahan bakar fosil, digunakan untuk menghasilkan energi panas yang kemudian diubah menjadi energi listrik. Sedangkan reaksi kimia endoterm, seperti reaksi dalam pembangkit listrik tenaga nuklir, membutuhkan energi panas untuk mempertahankan reaksi fisi nuklir.
Pemanasan dan Pendinginan
Pengetahuan tentang eksoterm dan endoterm juga digunakan dalam proses pemanasan dan pendinginan. Misalnya, dalam industri pembuatan es, reaksi endoterm digunakan untuk menghasilkan energi panas dari lingkungan sekitarnya untuk membekukan air menjadi es. Sementara itu, dalam sistem pendinginan, energi panas dari lingkungan diserap oleh zat pendingin untuk menurunkan suhu dan menjaga suhu yang diinginkan.
Industri Kimia
Di industri kimia, pemahaman tentang eksoterm dan endoterm sangat penting. Proses-proses kimia seperti reaksi oksidasi atau sintesis senyawa organik sering melibatkan reaksi eksoterm atau endoterm. Pemahaman ini memungkinkan para ahli kimia untuk merancang kondisi reaksi yang optimal dan mengendalikan perubahan energi yang terjadi selama proses tersebut.
Keterkaitan dengan Konsep Lain
Perbedaan eksoterm dan endoterm juga berkaitan dengan konsep energi dalam kimia. Energi kinetik dan energi potensial adalah dua jenis energi yang terlibat dalam proses reaksi kimia dan dapat diubah dalam reaksi eksoterm dan endoterm.
Energi Kinetik
Energi kinetik adalah energi yang dimiliki oleh benda karena gerakan molekul atau partikel di dalamnya. Dalam reaksi eksoterm, energi kinetik molekul-molekul reaktan meningkat karena adanya pelepasan energi panas. Sementara itu, dalam reaksi endoterm, energi kinetik molekul-molekul reaktan meningkat karena adanya penyerapan energi panas.
Energi Potensial
Energi potensial adalah energi yang dimiliki oleh suatu sistem berdasarkan posisi atau keadaan partikel di dalamnya. Dalam reaksi eksoterm, energi potensial reaktan menurun karena adanya pelepasan energi panas. Sementara itu, dalam reaksi endoterm, energi potensial reaktan meningkat karena adanya penyerapan energi panas.
Kesimpulan
Dalam artikel ini, kita telah menjelajahi perbedaan eksoterm dan endoterm secara rinci dan komprehensif. Eksoterm adalah jenis reaksi kimia yang melepaskan energi dalam bentuk panas, sementara endoterm adalah jenis reaksi kimia yang menyerap energi panas. Perbedaan dalam pelepasan dan penyerapan panas, energi aktivasi, pengaruh suhu terhadap reaksi, dan keterkaitan dengan konsep energi lainnya membedakan antara eksoterm dan endoterm. Pengetahuan tentang perbedaan ini penting dalam memahami reaksi kimia dan aplikasinya dalam kehidupan sehari-hari, serta dalam industri dan teknologi.
