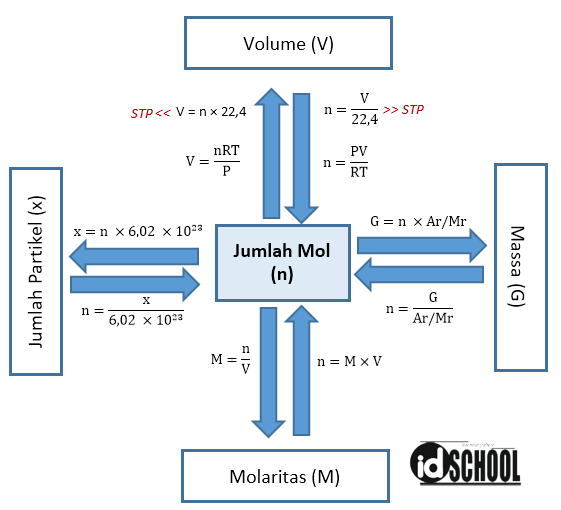
Konsep mol kimia merupakan salah satu konsep dasar dalam ilmu kimia yang sangat penting untuk memahami reaksi kimia, perhitungan stoikiometri, dan hubungan antara massa dan jumlah partikel dalam suatu zat. Dalam artikel ini, kami akan menjelaskan secara detail tentang konsep mol kimia, termasuk pengertian, rumus, dan contoh penggunaannya dalam kehidupan sehari-hari.
Mol adalah satuan dasar dalam kimia yang digunakan untuk mengukur jumlah partikel yang terkandung dalam suatu zat. Satu mol suatu zat mengandung jumlah partikel yang sama dengan jumlah atom yang terdapat dalam 12 gram karbon-12. Dalam satu mol karbon-12, terdapat sekitar 6,022 x 10^23 partikel, yang dikenal sebagai bilangan Avogadro. Bilangan Avogadro (NA) ini digunakan untuk menghubungkan massa zat dengan jumlah partikelnya.
Untuk menghitung jumlah mol suatu zat, kita dapat menggunakan rumus dasar yaitu massa zat dibagi dengan massa molar zat tersebut. Massa molar adalah massa satu mol suatu zat dan dinyatakan dalam satuan gram/mol. Dengan menggunakan konsep mol kimia, kita dapat melakukan perhitungan stoikiometri, yaitu perhitungan yang melibatkan hubungan antara jumlah partikel, massa, dan volume dalam suatu reaksi kimia.
Pengertian Mol Kimia
Mol adalah satuan dasar dalam kimia yang digunakan untuk mengukur jumlah partikel yang terkandung dalam suatu zat. Satu mol suatu zat mengandung jumlah partikel yang sama dengan jumlah atom yang terdapat dalam 12 gram karbon-12. Konsep mol kimia menjadi dasar penting dalam ilmu kimia karena dapat menghubungkan massa zat dengan jumlah partikelnya.
Asal Usul Konsep Mol
Konsep mol pertama kali diperkenalkan oleh seorang kimiawan Italia bernama Amedeo Avogadro pada tahun 1811. Avogadro menyadari bahwa volume gas yang sama pada suhu dan tekanan yang sama mengandung jumlah partikel yang berbeda-beda, terlepas dari jenis gasnya. Penemuan ini dikenal sebagai Hukum Avogadro, yang menyatakan bahwa volume yang sama dari gas yang berbeda akan mengandung jumlah partikel yang sama banyaknya jika diukur pada suhu dan tekanan yang sama.
Pada tahun 1865, Jean-Baptiste Perrin memperkenalkan istilah "mol" untuk menggambarkan jumlah partikel yang sama banyaknya dengan jumlah atom dalam 12 gram karbon-12. Dalam satu mol karbon-12, terdapat sekitar 6,022 x 10^23 partikel, yang dikenal sebagai bilangan Avogadro (NA). Bilangan Avogadro (NA) ini digunakan untuk menghubungkan massa zat dengan jumlah partikelnya.
Penggunaan Konsep Mol dalam Ilmu Kimia
Konsep mol kimia merupakan dasar penting dalam ilmu kimia karena menghubungkan massa zat dengan jumlah partikelnya. Dengan menggunakan konsep mol, kita dapat melakukan perhitungan stoikiometri, yaitu perhitungan yang melibatkan hubungan antara jumlah partikel, massa, dan volume dalam suatu reaksi kimia. Konsep mol juga digunakan dalam memahami persamaan reaksi kimia, menghitung konsentrasi larutan, dan menghitung volume gas.
Rumus Mol Kimia
Rumus mol kimia adalah rumus dasar yang digunakan untuk menghitung jumlah mol suatu zat berdasarkan massa zat dan massa molarnya. Rumus dasar untuk menghitung jumlah mol adalah:
Rumus Jumlah Mol
Jumlah mol = massa zat / massa molar zat
Massa molar adalah massa satu mol suatu zat dan dinyatakan dalam satuan gram/mol. Untuk menghitung jumlah mol suatu zat, kita perlu mengetahui massa zat dan massa molar zat tersebut. Dengan menggunakan rumus mol kimia, kita dapat menghitung jumlah mol suatu zat dengan mudah.
Contoh Penghitungan Jumlah Mol
Misalnya, kita ingin menghitung jumlah mol air (H2O) yang memiliki massa 18 gram. Massa molar air adalah 18 gram/mol. Dengan menggunakan rumus jumlah mol, kita dapat menghitung:
Jumlah mol air = 18 gram / 18 gram/mol = 1 mol
Jadi, jumlah mol air adalah 1 mol.
Massa Molar dan Massa Atom
Massa molar adalah massa satu mol suatu zat dan digunakan dalam perhitungan mol. Massa molar dinyatakan dalam satuan gram/mol. Massa molar suatu zat dapat dihitung dengan menjumlahkan massa atom-atom penyusun zat tersebut.
Massa Atom
Massa atom adalah massa relatif suatu atom dibandingkan dengan massa atom karbon-12. Massa atom biasanya dinyatakan dalam satuan massa atom relatif (u), di mana massa atom karbon-12 didefinisikan sebagai 12 u.
Contoh Penghitungan Massa Molar
Misalnya, kita ingin menghitung massa molar air (H2O). Air terdiri dari dua atom hidrogen (H) dan satu atom oksigen (O). Massa atom hidrogen adalah sekitar 1 u, sedangkan massa atom oksigen adalah sekitar 16 u. Dengan demikian, massa molar air dapat dihitung sebagai berikut:
Massa molar air = (2 x massa atom hidrogen) + massa atom oksigen
= (2 x 1 u) + 16 u
= 2 u + 16 u
= 18 u
Jadi, massa molar air adalah 18 gram/mol.
Menghitung Jumlah Partikel dalam Satu Mol
Bilangan Avogadro (NA) digunakan untuk menghubungkan massa zat dengan jumlah partikel dalam satu mol. Bilangan Avogadro adalah sekitar 6,022 x 10^23 partikel/mol. Dengan menggunakan bilangan Avogadro, kita dapat menghitung jumlah partikel dalam satu mol suatu zat.
Pengertian Bilangan Avogadro
Bilangan Avogadro diperoleh dari eksperimen yang dilakukan oleh Amedeo Avogadro. Avogadro menyadari bahwa volume gas yang sama pada suhu dan tekanan yang sama mengandung jumlah partikel yang berbeda-beda, terlepas dari jenis gasnya. Ia menyatakan bahwa volume yang sama dari gas yang berbeda akan mengandung jumlah partikel yang sama banyaknya jika diukur pada suhu dan tekanan yang sama.
Contoh Penghitungan Jumlah Partikel
Misalnya, kita ingin menghitung jumlah partikel dalam satu mol air (H2O). Bilangan Avogadro adalah sekitar 6,022 x 10^23 partikel/mol. Dengan menggunakan bilangan Avogadro, kita dapat menghitung:
Jumlah partikel air = jumlah mol air x bilangan Avogadro
= 1 mol x 6,022 x 10^23 partikel/mol
= 6,022 x 10^23 partikel
Jadi, jumlah partikel dalam satu mol air adalah sekitar 6,022 x 10^23 partikel.
Perhitungan Stoikiometri dengan Mol
Perhitungan stoikiometri adalah perhitungan yang melibatkan hubungan antara jumlah partikel, massa, dan volume dalam suatu reaksi kimia. Dengan menggunakan konsep mol kimia, kita dapat melakukan perhitungan stoikiometri dengan mudah.
Pengertian Perhitungan Stoikiometri
Perhitungan stoikiometri melibatkan perbandingan antara jumlah mol, massa, atau volume zat-zat yang terlibat dalam suatu reaksi kimia. Dalam perhitungan stoikiometri, kita menggunakan perbandingan mol yang diberikan oleh persamaan reaksi kimia untuk menghitung jumlah mol, massa, atau volume zat-zat yang terlibat dalam reaksi tersebut.
Contoh Perhitungan Stoikiometri
Misalnya, kita ingin menghitung jumlah mol dan massa air (H2O) yang dihasilkan dari reaksi pembakaran 2 mol metana (CH4). Dalam persamaan reaksi yang tepat, diketahui bahwa satu mol metana menghasilkan dua mol air. Dengan menggunakan perbandingan mol ini, kita dapat menghitung:
Jumlah mol air = jumlah mol metana x perbandingan mol air dari persamaan reaksi
= 2 mol x 2 mol air/1 mol metana
= 4 mol air
Jadi, jumlah mol air yang dihasilkan dari reaksi pembakaran 2 mol metana adalah 4 mol.
Selanjutnya, kita dapat menghitung massa air yang dihasilkan dengan menggunakan rumus jumlah mol:
Massa air = jumlah mol air x massa molar air
= 4 mol x 18 gram/mol
= 72 gram
Jadi, massa air yang dihasilkan dari reaksi pembakaran 2 mol metana adalah 72 gram.
Konsep Mol dan Persamaan Reaksi
Konsep mol sangat penting dalam memahami persamaan reaksi kimia. Dalam persamaan reaksi kimia, koefisien stoikiometri menunjukkan perbandingan antara jumlah mol zat-zat yang terlibat dalam reaksi. Dengan menggunakan konsep mol, kita dapat menghitung jumlah partikel yang terlibat dalam reaksi berdasarkan koefisien stoikiometri.
Penggunaan Konsep Mol dalam Memahami Persamaan Reaksi
Dalam persamaan reaksi kimia, koefisien stoikiometri menunjukkan perbandingan antara jumlah mol zat-zat yang terlibat dalam reaksi. Misalnya, dalam persamaan reaksi pembakaran metana (CH4 + 2O2 -> CO2 + 2H2O), koefisien stoikiometri menunjukkan bahwa satu mol metana bereaksi dengan dua mol oksigen menghasilkan satu mol karbon dioksida dan dua mol air.
Dengan menggunakan konsep mol, kita dapat menghitung jumlah partikel yang terlibat dalam reaksi berdasarkan koefisien stoikiometri. Misalnya, jika kita memiliki 3 mol metana, kita dapat menghitung:
Jumlah mol oksigen = jumlah mol metana x perbandingan mol oksigen/metana dari persamaan reaksi
= 3 mol x 2 mol oksigen/1 mol metana
= 6 mol oksigen
Jadi, jika kita memiliki 3 mol metana, kita membutuhkan 6 mol oksigen untuk reaksi tersebut.
Konsep Mol dalam Larutan
Konsep mol juga berperan penting dalam memahami konsentrasi larutan. Konsentrasi larutan dapat diukur dalam satuan mol per liter (mol/L). Dengan menggunakan konsep mol, kita dapat menghitung konsentrasi larutan berdasarkan jumlah mol zat terlarut dan volume larutan.
Penggunaan Konsep Mol dalam Menghitung Konsentrasi Larutan
Untuk menghitung konsentrasi larutan dalam satuan mol/L, kita perlu mengetahui jumlah mol zat terlarut dan volume larutan. Misalnya, jika kita memiliki 0,5 mol gula (C12H22O11) dalam 1 liter larutan, maka konsentrasi larutan gula adalah:
Konsentrasi larutan gula = jumlah mol gula / volume larutan
= 0,5 mol / 1 L
= 0,5 mol/L
Jadi, konsentrasi larutan gula adalah 0,5 mol/L.
Konsep Mol dalam Gas
Konsep mol juga berlaku pada gas. Dalam gas, volume dapat diukur dalam satuan liter dan jumlah partikel dapat diukur dalam satuan mol. Dengan menggunakan konsep mol, kita dapat menghitung volume gas dalam kondisi standar dan kondisi non-standar.
Penggunaan Konsep Mol dalam Menghitung Volume Gas
Dalam kondisi standar, satu mol gas akan memiliki volume sekitar 22,4 liter. Dengan menggunakan konsep mol, kita dapat menghitung volume gas dalam kondisi standar jika diketahui jumlah mol gas. Misalnya, jika kita memiliki 0,5 mol gas nitrogen (N2), maka volume gas nitrogen dalam kondisi standar adalah:
Volume gas nitrogen = jumlah mol gas nitrogen x volume gas nitrogen standar per mol
= 0,5 mol x 22,4 L/mol
= 11,2 L
Jadi, volume gas nitrogen dalam kondisi standar adalah 11,2 liter.
Dalam kondisi non-standar, kita perlu memperhitungkan faktor suhu dan tekanan. Hukum gas ideal menyatakan bahwa volume gas berbanding lurus dengan jumlah mol gas, suhu, dan terbalik lurus dengan tekanan. Dengan menggunakan konsep mol, kita dapat menghitung volume gas dalam kondisi non-standar jika diketahui jumlah mol gas, suhu, dan tekanan.
Contoh Penggunaan Konsep Mol dalam Kehidupan Sehari-hari
Konsep mol kimia tidak hanya relevan dalam laboratorium, tetapi juga berlaku dalam kehidupan sehari-hari. Beberapa contoh penggunaan konsep mol dalam kehidupan sehari-hari antara lain:
Pembuatan Makanan dan Minuman
Konsep mol digunakan dalam pembuatan makanan dan minuman. Dalam resep, perbandingan bahan-bahan berdasarkan jumlah mol sangat penting untuk mendapatkan rasa yang tepat. Misalnya, dalam pembuatan roti, perbandingan jumlah mol tepung, air, ragi, dan bahan-bahan lainnya harus tepat agar roti dapat mengembang dengan baik.
Penggunaan Obat-obatan
Konsep mol juga digunakan dalam penggunaan obat-obatan. Dalam dosis obat, perhitungan jumlah mol zat aktif sangat penting untuk memberikan dosis yang tepat sesuai dengan kebutuhan pasien. Dengan menggunakan konsep mol, dosis obat dapat dihitung berdasarkan berat molekul zat aktif dan kebutuhan pasien.
Pembuatan Bahan Kimia
Konsep mol digunakan dalam pembuatan bahan kimia seperti pupuk, deterjen, dan bahan kimia lainnya. Dalam produksi bahan kimia, perhitungan jumlah mol bahan-bahan yang digunakan sangat penting untuk menghasilkan produk yang konsisten dan berkualitas.
Pembakaran Bahan Bakar
Konsep mol juga terkait dengan pembakaran bahan bakar. Dalam pembakaran, perhitungan jumlah mol bahan bakar dan oksigen sangat penting untuk mendapatkan efisiensi pembakaran yang optimal. Dengan menggunakan konsep mol, kita dapat menghitung jumlah bahan bakar dan oksigen yang dibutuhkan dalam pembakaran untuk menghasilkan energi yang maksimal.
Pengukuran Konsentrasi Zat
Konsep mol digunakan dalam pengukuran konsentrasi zat dalam larutan. Konsentrasi larutan dapat diukur dalam satuan mol per liter (mol/L). Dalam bidang kimia analitik, pengukuran konsentrasi zat sangat penting untuk analisis kualitatif dan kuantitatif.
Pengukuran Volume Gas
Konsep mol juga digunakan dalam pengukuran volume gas. Dalam kondisi standar, satu mol gas akan memiliki volume sekitar 22,4 liter. Dalam kondisi non-standar, kita perlu memperhitungkan suhu dan tekanan untuk menghitung volume gas yang tepat.
Kesimpulan
Sebagai konsep dasar dalam ilmu kimia, konsep mol kimia sangat penting untuk memahami reaksi kimia, perhitungan stoikiometri, dan hubungan antara massa dan jumlah partikel dalam suatu zat. Dalam artikel ini, kami telah menjelaskan secara detail tentang pengertian, rumus, dancontoh penggunaan konsep mol kimia. Konsep mol kimia digunakan dalam menghitung jumlah mol suatu zat berdasarkan massa zat dan massa molarnya. Dengan menggunakan konsep mol, kita dapat melakukan perhitungan stoikiometri, menghitung konsentrasi larutan, menghitung volume gas, dan memahami persamaan reaksi kimia.
Pentingnya konsep mol kimia terlihat dalam berbagai aplikasi dalam kehidupan sehari-hari. Dalam pembuatan makanan dan minuman, perbandingan jumlah mol bahan-bahan dalam resep sangat penting untuk mendapatkan rasa yang tepat. Misalnya, dalam pembuatan roti, perbandingan jumlah mol tepung, air, ragi, dan bahan-bahan lainnya harus tepat agar roti dapat mengembang dengan baik.
Selain itu, konsep mol juga relevan dalam penggunaan obat-obatan. Dalam dosis obat, perhitungan jumlah mol zat aktif sangat penting untuk memberikan dosis yang tepat sesuai dengan kebutuhan pasien. Dengan menggunakan konsep mol, dosis obat dapat dihitung berdasarkan berat molekul zat aktif dan kebutuhan pasien.
Dalam pembuatan bahan kimia, seperti pupuk atau deterjen, konsep mol digunakan untuk menghitung jumlah mol bahan-bahan yang digunakan. Dalam produksi bahan kimia, perhitungan jumlah mol yang tepat sangat penting untuk menghasilkan produk yang konsisten dan berkualitas.
Konsep mol juga terkait dengan pembakaran bahan bakar. Dalam pembakaran, perhitungan jumlah mol bahan bakar dan oksigen sangat penting untuk mendapatkan efisiensi pembakaran yang optimal. Dengan menggunakan konsep mol, kita dapat menghitung jumlah bahan bakar dan oksigen yang dibutuhkan dalam pembakaran untuk menghasilkan energi yang maksimal.
Dalam bidang kimia analitik, konsep mol digunakan dalam pengukuran konsentrasi zat dalam larutan. Konsentrasi larutan dapat diukur dalam satuan mol per liter (mol/L). Pengukuran konsentrasi zat sangat penting dalam analisis kualitatif dan kuantitatif.
Selain itu, konsep mol juga digunakan dalam pengukuran volume gas. Dalam kondisi standar, satu mol gas akan memiliki volume sekitar 22,4 liter. Dalam kondisi non-standar, suhu dan tekanan perlu dipertimbangkan untuk menghitung volume gas yang tepat.
Dengan memahami konsep mol kimia, kita dapat lebih mudah dalam melakukan perhitungan stoikiometri, memahami hubungan antara massa dan jumlah partikel dalam suatu zat, dan memahami reaksi kimia secara lebih mendalam. Konsep mol kimia merupakan dasar penting dalam ilmu kimia yang berperan dalam berbagai aplikasi dalam kehidupan sehari-hari.
