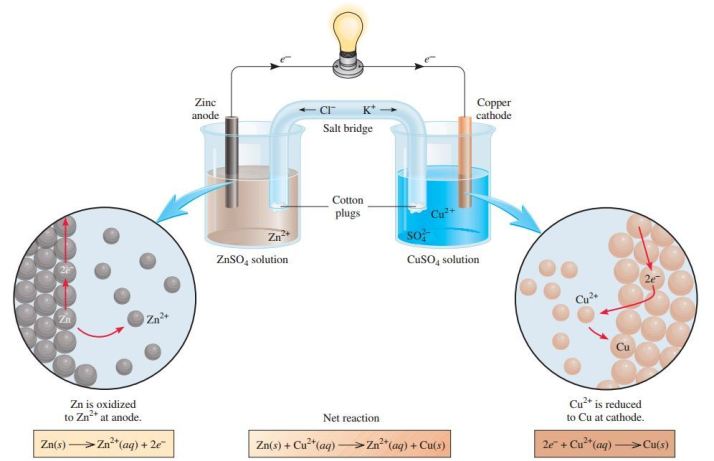
Elektro kimia adalah cabang ilmu yang mempelajari hubungan antara reaksi kimia dan energi listrik. Dalam artikel ini, kita akan menjelajahi dunia elektro kimia secara rinci dan menyeluruh. Dari konsep dasar hingga aplikasi praktisnya, mari kita pelajari lebih lanjut tentang ilmu yang menarik ini.
Di dalam elektro kimia, kita mempelajari reaksi redoks, yang melibatkan aliran elektron dari satu zat ke zat lainnya. Elektroda, yaitu penghantar listrik yang terdiri dari logam atau bahan lainnya, memainkan peran penting dalam reaksi ini. Dalam elektro kimia, kita dapat mengendalikan reaksi redoks dengan memanipulasi potensial elektroda. Dengan memahami konsep ini, kita dapat menghasilkan energi listrik melalui reaksi redoks, seperti pada baterai.
Konsep Dasar Elektro Kimia
Pada bagian ini, kita akan menjelaskan konsep dasar dalam elektro kimia, termasuk hukum Faraday, potensial elektroda, dan sel elektrokimia. Kita akan mempelajari bagaimana reaksi redoks terjadi dan bagaimana aliran elektron dikendalikan dalam sistem elektro kimia.
Hukum Faraday
Hukum Faraday merupakan prinsip dasar dalam elektro kimia yang menjelaskan hubungan antara aliran listrik, jumlah zat yang terlibat, dan massa yang dihasilkan dalam reaksi elektrokimia. Hukum Faraday menyatakan bahwa massa zat yang dihasilkan atau dikonsumsi dalam elektrolisis sebanding dengan jumlah muatan listrik yang dilewatkan melalui larutan elektrolit.
Potensial Elektroda
Potensial elektroda merupakan ukuran kemampuan elektroda untuk menerima atau melepaskan elektron dalam sebuah sel elektrokimia. Potensial elektroda dapat digunakan untuk memprediksi arah aliran elektron dalam reaksi redoks. Elektroda dengan potensial positif cenderung melepaskan elektron, sedangkan elektroda dengan potensial negatif cenderung menerima elektron.
Sel Elektrokimia
Sel elektrokimia adalah sistem di mana reaksi redoks terjadi secara terkontrol dan menghasilkan energi listrik. Sel elektrokimia terdiri dari dua elektroda, yaitu anoda (elektroda negatif) dan katoda (elektroda positif), yang terhubung melalui elektrolit. Dalam sel elektrokimia, reaksi redoks terjadi di permukaan elektroda, dan aliran elektron melalui sirkuit eksternal menghasilkan arus listrik.
Elektrolisis: Memahami Proses Pembuatan Logam
Elektrolisis adalah proses di mana listrik digunakan untuk memisahkan senyawa menjadi unsur-unsurnya. Dalam bagian ini, kita akan membahas proses elektrolisis secara rinci, termasuk aplikasinya dalam pembuatan logam dari bijih. Kita juga akan melihat bagaimana elektrolisis dapat digunakan untuk pemurnian logam dan pengolahan limbah.
Proses Elektrolisis
Proses elektrolisis melibatkan penggunaan arus listrik yang melewati larutan elektrolit. Arus listrik ini menyebabkan reaksi redoks terjadi di permukaan elektroda. Anoda, elektroda positif, adalah tempat oksidasi terjadi, sedangkan katoda, elektroda negatif, adalah tempat reduksi terjadi. Dalam proses elektrolisis, senyawa yang terdapat dalam larutan elektrolit dipecah menjadi unsur-unsurnya.
Aplikasi dalam Pembuatan Logam
Elektrolisis digunakan dalam industri untuk memisahkan logam dari bijihnya. Proses ini dikenal sebagai elektrorefining atau elektrodeposisi. Dalam elektrorefining, bijih logam dilarutkan dalam larutan elektrolit, dan arus listrik yang dilewatkan melalui larutan menyebabkan logam terendapkan pada katoda. Ini memungkinkan pemurnian logam dengan tingkat kemurnian yang tinggi.
Pengolahan Limbah
Selain dalam pembuatan logam, elektrolisis juga digunakan dalam pengolahan limbah. Dalam proses yang disebut elektrokoagulasi, arus listrik digunakan untuk mengendapkan partikel-partikel terlarut atau terdispersi dalam air limbah. Elektrokoagulasi efektif dalam menghilangkan logam berat, zat pewarna, dan bahan organik dari limbah.
Baterai: Sumber Energi Portabel
Baterai adalah salah satu aplikasi praktis dari elektro kimia yang paling umum. Pada sesi ini, kita akan membahas jenis-jenis baterai, seperti baterai aki dan baterai litium-ion. Kita juga akan melihat bagaimana baterai bekerja dan bagaimana elektro kimia terlibat dalam menghasilkan energi listrik.
Jenis-Jenis Baterai
Terdapat berbagai jenis baterai yang digunakan dalam berbagai aplikasi. Baterai aki, juga dikenal sebagai baterai timbal-asam, merupakan jenis baterai yang umum digunakan dalam mobil, kapal, dan sistem tenaga darurat. Baterai litium-ion, di sisi lain, digunakan dalam perangkat elektronik portabel seperti ponsel, laptop, dan kamera digital.
Prinsip Kerja Baterai
Baterai bekerja berdasarkan prinsip elektrokimia, di mana reaksi redoks terjadi di dalam sel baterai. Di dalam baterai aki, reaksi redoks terjadi antara elektroda timbal di anoda dan elektroda seng di katoda. Baterai litium-ion, di sisi lain, menggunakan elektroda berbasis lithium dan senyawa elektrolit organik untuk menghasilkan energi listrik.
Proses Pengisian dan Pengosongan Baterai
Pada saat baterai diisi ulang, reaksi redoks terbalik terjadi, dan bahan aktif di elektroda mengalami perubahan kimia. Saat baterai digunakan dan menghasilkan energi listrik, reaksi redoks terjadi di dalam sel baterai. Proses pengisian dan pengosongan ini memungkinkan baterai untuk digunakan berulang kali.
Korosi: Musuh Tersembunyi Logam
Korosi adalah proses di mana logam teroksidasi oleh reaksi redoks dengan oksigen. Dalam sesi ini, kita akan membahas faktor-faktor yang mempengaruhi korosi, cara mencegahnya, dan bagaimana elektro kimia dapat digunakan untuk melindungi logam dari korosi.
Faktor-Faktor yang Mempengaruhi Korosi
Ada beberapa faktor yang mempengaruhi tingkat korosi pada logam, termasuk kelembaban, suhu, pH, keasaman, dan konsentrasi oksigen dalam lingkungan. Logam yang terkena korosi dapat mengalami kerusakan struktural dan kehilangan fungsinya, yang dapat berdampak pada keamanan dan keandalan suatu sistem.
Pencegahan Korosi
Untuk mencegah korosi logam, beberapa langkah pencegahan dapat diambil. Salah satunya adalah melapisi logam dengan lapisan pelindung, seperti cat atau lapisan anti karat. Penggunaan logam yang lebih tahan terhadap korosi, seperti stainless steel atau paduan khusus, juga dapat mengurangi risiko korosi.
Proteksi Katodik
Proteksi katod
Proteksi Katodik
Proteksi katodik adalah metode yang menggunakan prinsip elektro kimia untuk melindungi logam dari korosi. Dalam proteksi katodik, logam yang ingin dilindungi dihubungkan dengan elektroda yang lebih aktif secara elektrokimia, seperti magnesium atau aluminium. Elektroda ini bertindak sebagai katoda yang menarik korosi sehingga logam yang ingin dilindungi tetap terlindungi.
Sensor Elektrokimia: Mendeteksi Zat dalam Larutan
Para ilmuwan telah mengembangkan sensor elektrokimia yang dapat mendeteksi zat tertentu dalam larutan. Pada sesi ini, kita akan membahas prinsip kerja sensor elektrokimia, jenis-jenisnya, dan aplikasinya dalam berbagai bidang, seperti analisis air dan pengujian obat-obatan.
Prinsip Kerja Sensor Elektrokimia
Sensor elektrokimia bekerja berdasarkan perubahan potensial elektroda yang terjadi saat senyawa spesifik berinteraksi dengan elektroda. Ketika senyawa yang ingin dideteksi berada dalam larutan, reaksi redoks terjadi di permukaan elektroda yang menghasilkan perubahan potensial. Perubahan ini kemudian diukur dan digunakan untuk mendeteksi konsentrasi senyawa dalam larutan.
Jenis-Jenis Sensor Elektrokimia
Terdapat beberapa jenis sensor elektrokimia yang digunakan dalam berbagai aplikasi. Sensor pH, misalnya, digunakan untuk mengukur tingkat keasaman atau kebasaan larutan. Sensor ion selektif, di sisi lain, digunakan untuk mendeteksi ion spesifik seperti natrium, kalsium, atau logam berat. Sensor gas elektrokimia digunakan untuk mendeteksi konsentrasi gas tertentu dalam udara.
Aplikasi dalam Analisis Air
Sensor elektrokimia memiliki berbagai aplikasi dalam analisis air. Misalnya, sensor pH digunakan untuk mengukur tingkat keasaman atau kebasaan air, yang penting dalam pengolahan air minum. Sensor ion selektif digunakan untuk mengukur konsentrasi ion tertentu dalam air, seperti konsentrasi klorida dalam air kolam renang.
Aplikasi dalam Pengujian Obat-Obatan
Sensor elektrokimia juga digunakan dalam pengujian obat-obatan. Sensor elektrokimia dapat digunakan untuk mendeteksi konsentrasi obat dalam darah atau urin. Hal ini penting dalam pemantauan terapi obat dan pengujian narkotika.
Elektrokimia Industri: Meningkatkan Efisiensi Proses Kimia
Elektro kimia juga memiliki banyak aplikasi dalam industri. Pada bagian ini, kita akan melihat bagaimana elektro kimia dapat digunakan untuk meningkatkan efisiensi proses kimia, seperti elektrodeposisi logam, elektrolisis industri, dan sel bahan bakar.
Elektrodeposisi Logam
Elektrodeposisi logam adalah proses di mana logam dideposisikan pada permukaan elektroda melalui reaksi redoks. Proses ini digunakan dalam industri untuk menghasilkan lapisan logam yang tahan korosi, meningkatkan daya tahan logam, atau memberikan tampilan yang menarik. Misalnya, elektrodeposisi digunakan dalam pembuatan perhiasan, pelapisan kawat, atau produksi komponen elektronik.
Elektrolisis Industri
Elektrolisis juga digunakan dalam industri untuk memproduksi bahan kimia tertentu. Misalnya, elektrolisis digunakan dalam produksi klorin, natrium hidroksida, dan aluminium. Proses elektrolisis ini dapat meningkatkan efisiensi produksi dan mengurangi dampak lingkungan dibandingkan dengan metode tradisional.
Sel Bahan Bakar
Sel bahan bakar adalah sistem elektrokimia yang menghasilkan energi listrik melalui reaksi redoks antara bahan bakar dan oksidator. Sel bahan bakar memiliki potensi untuk menggantikan mesin pembakaran internal sebagai sumber energi yang lebih efisien dan bersih. Dalam sel bahan bakar, reaksi redoks antara hidrogen dan oksigen menghasilkan listrik dan air sebagai produk sampingan.
Elektrokimia Biologi: Listrik dalam Tubuh Kita
Ternyata, elektro kimia juga memainkan peran penting dalam tubuh manusia dan makhluk hidup lainnya. Pada sesi ini, kita akan membahas tentang potensial aksi dalam sistem saraf, elektrokardiografi, dan aplikasi elektro kimia dalam perangkat medis.
Potensial Aksi dalam Sistem Saraf
Sistem saraf mengoperasikan impuls listrik dalam tubuh kita melalui potensial aksi. Potensial aksi adalah perubahan tiba-tiba dalam potensial listrik di sepanjang sel saraf yang memungkinkan transmisi sinyal listrik. Ini memungkinkan komunikasi dan koordinasi antara sel-sel saraf di tubuh kita.
Elektrokardiografi
Elektrokardiografi adalah proses perekaman dan analisis aktivitas listrik jantung kita. Elektrokardiogram (EKG) adalah grafik yang merekam aktivitas listrik jantung, yang digunakan untuk mendiagnosis gangguan jantung dan mengawasi kesehatan jantung. Elektrokardiografi berbasis elektro kimia dan memanfaatkan elektroda yang ditempatkan pada kulit untuk merekam sinyal listrik jantung.
Aplikasi Elektro Kimia dalam Perangkat Medis
Elektro kimia juga memiliki banyak aplikasi dalam perangkat medis. Misalnya, elektroda digunakan dalam pemeriksaan elektroensefalografi (EEG) untuk merekam aktivitas listrik otak. Elektroda juga digunakan dalam stimulasi saraf, pengobatan nyeri, dan pemantauan kadar glukosa dalam darah bagi penderita diabetes.
Elektrokimia Lingkungan: Mengatasi Tantangan Lingkungan
Aplikasi elektro kimia juga dapat ditemukan dalam bidang lingkungan. Dalam bagian ini, kita akan melihat bagaimana elektro kimia dapat digunakan untuk memecahkan masalah lingkungan, seperti pemurnian air, pengolahan limbah, dan pengurangan emisi gas rumah kaca.
Pemurnian Air
Elektro kimia digunakan dalam pemurnian air untuk menghilangkan kontaminan seperti logam berat, pestisida, dan zat organik. Metode pemurnian air elektro kimia, seperti elektrokoagulasi, elektrodialisis, dan elektrooksidasi, telah terbukti efektif dalam menghasilkan air bersih yang aman untuk dikonsumsi.
Pengolahan Limbah
Pengolahan limbah menggunakan elektro kimia dapat mengurangi dampak lingkungan limbah industri. Metode elektro kimia, seperti elektrokoagulasi dan elektrooksidasi, dapat digunakan untuk menghilangkan kontaminan dari air limbah dan mengubahnya menjadi senyawa yang lebih aman atau mudah diuraikan.
Pengurangan Emisi Gas Rumah Kaca
Elektro kimia juga dapat digunakan untuk mengurangi emisi gas rumah kaca. Misalnya, elektrolisis air digunakan untuk menghasilkan hidrogen sebagai bahan bakar alternatif yang ramah lingkungan. Sel bahan bakar juga dapat digunakan untuk menghasilkan energi listrik tanpa emisi gas rumah kaca.
Elektrokimia Masa Depan: Energi Terbarukan dan Penyimpanan
Di masa depan, ele
Elektrokimia Masa Depan: Energi Terbarukan dan Penyimpanan
Di masa depan, elektro kimia akan memainkan peran penting dalam pengembangan energi terbarukan dan penyimpanan energi. Pada sesi ini, kita akan membahas penelitian terkini dan inovasi dalam elektro kimia yang berpotensi mengubah cara kita menghasilkan dan menggunakan energi.
Energi Terbarukan
Elektro kimia dapat digunakan untuk menghasilkan energi terbarukan, seperti energi surya dan energi angin. Dalam teknologi sel surya, elektro kimia digunakan untuk mengubah energi matahari menjadi energi listrik melalui proses fotoelektrokimia. Sedangkan dalam energi angin, elektro kimia dapat digunakan dalam baterai penyimpanan energi yang digunakan untuk menyimpan energi yang dihasilkan oleh turbin angin.
Penyimpanan Energi
Penyimpanan energi merupakan tantangan dalam pengembangan sumber energi terbarukan. Elektro kimia dapat memberikan solusi dalam penyimpanan energi melalui pengembangan baterai yang lebih efisien dan tahan lama. Penelitian terus dilakukan untuk meningkatkan kapasitas, kecepatan pengisian, dan umur pakai baterai, sehingga energi terbarukan dapat disimpan dan digunakan secara lebih efektif.
Elektrolisis Air untuk Produksi Hidrogen
Elektrolisis air adalah metode yang menggunakan elektro kimia untuk memisahkan air menjadi hidrogen dan oksigen. Hidrogen dapat digunakan sebagai bahan bakar alternatif yang ramah lingkungan. Dalam penelitian terkini, elektro kimia digunakan untuk mengembangkan metode elektrolisis yang lebih efisien dan ekonomis sehingga produksi hidrogen dapat dilakukan secara lebih berkelanjutan.
Tantangan dan Peluang dalam Elektro Kimia
Terakhir, kita akan melihat tantangan dan peluang yang dihadapi oleh elektro kimia. Dengan pemahaman yang lebih mendalam tentang tantangan ini, kita dapat mengembangkan solusi yang lebih baik dan memanfaatkan peluang untuk mendorong perkembangan ilmu ini ke depan.
Tantangan dalam Elektro Kimia
Salah satu tantangan dalam elektro kimia adalah pengembangan dan penggunaan material elektroda yang lebih efisien dan tahan lama. Material elektroda saat ini masih memiliki keterbatasan dalam hal kecepatan reaksi, kapasitas, dan stabilitas. Selain itu, skalabilitas proses elektrokimia juga menjadi tantangan, terutama dalam produksi massal.
Peluang dalam Elektro Kimia
Perkembangan teknologi dan penelitian terus memberikan peluang dalam elektro kimia. Dengan kemajuan dalam bidang nanoteknologi dan material baru, material elektroda yang lebih efisien dan tahan lama dapat dikembangkan. Selain itu, pengembangan metode elektro kimia yang lebih ramah lingkungan dan berkelanjutan juga menjadi peluang penting dalam menghadapi perubahan iklim dan meningkatkan efisiensi energi.
Dalam kesimpulan, elektro kimia merupakan bidang ilmu yang menarik dan memiliki potensi besar dalam berbagai aspek kehidupan kita. Dari aplikasi praktis seperti baterai hingga pengembangan energi terbarukan dan penyimpanan energi, elektro kimia terus berperan dalam mencari solusi untuk tantangan lingkungan dan kebutuhan energi. Dengan pemahaman yang lebih mendalam tentang elektro kimia, kita dapat terus mengeksplorasi dan memanfaatkan potensinya untuk masa depan yang lebih berkelanjutan dan efisien secara energi.
