Afinitas elektron adalah salah satu konsep penting dalam kimia yang berkaitan dengan kemampuan suatu atom untuk menarik elektron tambahan. Konsep ini sangat relevan dalam memahami sifat-sifat unsur dan reaktivitas kimia. Dalam artikel ini, kita akan menjelaskan secara rinci mengenai afinitas elektron, mengapa penting untuk dipahami, serta memberikan contoh-contoh yang dapat memperjelas konsep ini.
Pertama-tama, mari kita pahami apa itu afinitas elektron. Afinitas elektron adalah ukuran energi yang dibutuhkan atau dilepaskan ketika sebuah atom menambahkan satu elektron ke kulit terluarnya. Jika proses ini melepaskan energi, afinitas elektron negatif, yang berarti atom tersebut cenderung menerima elektron tambahan. Namun, jika proses ini membutuhkan energi, afinitas elektron positif, yang berarti atom tersebut kurang cenderung menerima elektron tambahan.
Sekarang, mari kita bahas mengapa afinitas elektron penting dalam kimia. Afinitas elektron dapat memberikan informasi tentang kecenderungan suatu atom untuk membentuk ikatan kimia dengan atom lain. Semakin tinggi afinitas elektron suatu atom, semakin besar kecenderungannya untuk menarik elektron dari atom lain, sehingga kemungkinan pembentukan ikatan kimia yang kuat lebih tinggi. Selain itu, afinitas elektron juga dapat mempengaruhi sifat-sifat fisik dan kimia suatu senyawa, seperti titik lebur dan titik didih.
Pengertian Afinitas Elektron
Pengertian afinitas elektron dapat dijelaskan lebih rinci sebagai ukuran energi yang dilepaskan atau diserap ketika sebuah atom menambahkan satu elektron ke kulit terluarnya. Afinitas elektron dapat dianggap sebagai indikator kecenderungan suatu atom untuk menarik elektron tambahan. Dalam konteks ini, afinitas elektron yang negatif menunjukkan bahwa atom tersebut cenderung menerima elektron tambahan, sedangkan afinitas elektron yang positif menunjukkan bahwa atom tersebut kurang cenderung menerima elektron tambahan.
Secara matematis, afinitas elektron dapat dihitung sebagai selisih antara energi atom setelah menambahkan satu elektron dengan energi atom sebelum menambahkan elektron. Jika energi atom meningkat setelah menambahkan elektron, afinitas elektron akan memiliki nilai positif. Namun, jika energi atom menurun setelah menambahkan elektron, afinitas elektron akan memiliki nilai negatif.
Rumus Matematis Afinitas Elektron
Rumus matematis yang digunakan untuk menghitung afinitas elektron adalah sebagai berikut:
Afinitas Elektron = Energi Atom Setelah Menambahkan Elektron - Energi Atom Sebelum Menambahkan Elektron
Nilai afinitas elektron biasanya dinyatakan dalam satuan energi seperti elektronvolt (eV). Semakin besar nilai afinitas elektron, semakin besar kecenderungan atom untuk menarik elektron tambahan.
Faktor-faktor yang Mempengaruhi Afinitas Elektron
Terdapat beberapa faktor yang mempengaruhi afinitas elektron suatu atom. Faktor-faktor ini dapat mempengaruhi kemampuan atom untuk menarik atau menerima elektron tambahan. Dalam menjelaskan faktor-faktor ini, kita dapat lebih memahami variasi afinitas elektron antara unsur-unsur dalam sistem periodik.
Ukuran Atom
Ukuran atom merupakan faktor yang mempengaruhi afinitas elektron. Secara umum, semakin kecil ukuran atom, semakin tinggi afinitas elektronnya. Hal ini disebabkan oleh jarak yang lebih dekat antara inti atom dan kulit elektron terluarnya. Inti atom yang lebih kuat menarik elektron lebih kuat sehingga afinitas elektron cenderung lebih tinggi.
Sebagai contoh, jika kita membandingkan afinitas elektron antara unsur fluorin (F) dan unsur iodin (I), kita akan melihat bahwa fluorin memiliki afinitas elektron yang lebih tinggi. Hal ini disebabkan oleh ukuran atom fluorin yang lebih kecil dibandingkan iodin. Ukuran atom yang lebih kecil membuat interaksi antara inti atom dan elektron menjadi lebih kuat, sehingga afinitas elektronnya lebih tinggi.
Muatan Inti
Muatan inti juga mempengaruhi afinitas elektron suatu atom. Semakin besar muatan inti, semakin tinggi afinitas elektronnya. Hal ini karena muatan inti yang lebih besar menarik elektron lebih kuat.
Sebagai contoh, jika kita membandingkan afinitas elektron antara unsur litium (Li) dan unsur natrium (Na), kita akan melihat bahwa litium memiliki afinitas elektron yang lebih tinggi. Hal ini disebabkan oleh muatan inti yang lebih besar pada litium dibandingkan natrium. Muatan inti litium yang lebih besar menarik elektron lebih kuat, sehingga afinitas elektronnya lebih tinggi.
Konfigurasi Elektron
Konfigurasi elektron juga berperan dalam menentukan afinitas elektron. Konfigurasi elektron menggambarkan distribusi elektron dalam atom dan mempengaruhi interaksi antara inti atom dan elektron terluarnya.
Sebagai contoh, jika kita membandingkan afinitas elektron antara unsur oksigen (O) dan unsur nitrogen (N), kita akan melihat bahwa oksigen memiliki afinitas elektron yang lebih tinggi. Hal ini disebabkan oleh konfigurasi elektron yang berbeda antara kedua unsur tersebut. Konfigurasi elektron oksigen memiliki elektron tambahan pada kulit terluarnya, sehingga interaksi antara inti atom dan elektron lebih kuat, dan afinitas elektronnya lebih tinggi.
Afinitas Elektron dalam Sistem Periodik
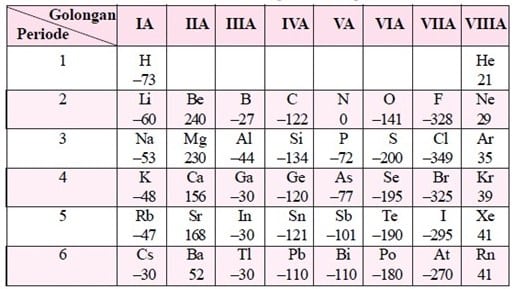
Afinitas elektron bervariasi dalam tabel periodik dan menunjukkan pola tertentu. Dalam menjelaskan variasi ini, kita dapat memahami tren periodik dan kecenderungan afinitas elektron antara unsur-unsur.
Tren Afinitas Elektron dalam Tabel Periodik
Secara umum, afinitas elektron cenderung meningkat dari kiri ke kanan dalam periode dan dari bawah ke atas dalam golongan dalam tabel periodik. Hal ini disebabkan oleh perubahan ukuran atom, muatan inti, dan konfigurasi elektron pada unsur-unsur tersebut.
Pada periode, ukuran atom cenderung mengecil dari kiri ke kanan. Hal ini menyebabkan jarak yang lebih dekat antara inti atom dan kulit elektron terluarnya, sehingga interaksi antara keduanya menjadi lebih kuat. Seiring dengan peningkatan muatan inti dan konfigurasi elektron, afinitas elektron cenderung meningkat.
Pada golongan, afinitas elektron cenderung menurun dari atas ke bawah. Hal ini disebabkan oleh peningkatan ukuran atom dan jarak yang lebih jauh antara inti atom dan kulit elektron terluarnya. Interaksi antara inti atom dan elektron menjadi lebih lemah, sehingga afinitas elektron cenderung menurun.
Unsur dengan Afinitas Elektron Tertinggi dan Terendah
Unsur dengan afinitas elektron tertinggi biasanya ditemukan pada unsur-unsur golongan halogen. Halogen memiliki konfigurasi elektron yang hampir mencapai konfigurasi gas mulia dengan satu elektron tersisa pada kulit terluarnya. Oleh karena itu, mereka memiliki afinitas elektron yang sangat tinggi karena cenderung menerima satu elektron tambahan untuk mencapai konfigurasi gas mulia yang lebih stabil.
Sebagai contoh, unsur fluorin (F) memiliki afinitas elektron tertinggi dalam tabel periodik. Fluorin memiliki afinitas elektron yang sangat tinggi karena memiliki konfigurasi elektron 1s^2 2s^2 2p^5. Dengan memiliki hanya satu elektron tersisa pada kulit p terluarnya, fluorin memiliki kecenderungan besar untuk menarik elektron tambahan dan mencapai konfigurasi gas mulia yang stabil. Hal ini membuatnya menjadi salah satu unsur paling reaktif dalam sistem periodik.
Di sisi lain, unsur dengan afinitas elektron terendah biasanya ditemukan pada unsur-unsur golongan alkali. Unsur alkali memiliki konfigurasi elektron dengan satu elektron pada kulit terluarnya. Karena itu, mereka cenderung melepaskan elektron terluarnya untuk mencapai konfigurasi gas mulia yang lebih stabil. Oleh karena itu, afinitas elektron mereka cenderung lebih rendah dibandingkan dengan unsur-unsur lain dalam sistem periodik.
Sebagai contoh, unsur litium (Li) memiliki afinitas elektron terendah dalam tabel periodik. Litium memiliki konfigurasi elektron 1s^2 2s^1, dengan satu elektron pada kulit terluarnya. Litium cenderung melepaskan elektron ini untuk mencapai konfigurasi gas mulia helium yang stabil. Oleh karena itu, afinitas elektron litium memiliki nilai yang negatif, menunjukkan kecenderungan untuk melepaskan elektron, bukan menerima elektron tambahan.
Contoh-contoh Afinitas Elektron
Untuk memperjelas konsep afinitas elektron, mari kita lihat beberapa contoh afinitas elektron dari unsur-unsur yang berbeda. Contoh-contoh ini akan membantu kita memahami bagaimana afinitas elektron mempengaruhi sifat kimia unsur dan kemungkinan pembentukan ikatan kimia.
Afinitas Elektron Fluorin (F)
Fluorin adalah unsur dengan afinitas elektron tertinggi dalam tabel periodik. Dengan konfigurasi elektron 1s^2 2s^2 2p^5, fluorin hanya memiliki satu elektron tersisa untuk mencapai konfigurasi gas mulia neon yang stabil. Oleh karena itu, fluorin memiliki afinitas elektron yang sangat tinggi karena cenderung menarik elektron tambahan dan membentuk ion negatif (F^-).
Afinitas Elektron Litium (Li)
Sebagai kontras dengan fluorin, litium memiliki afinitas elektron yang negatif. Dengan konfigurasi elektron 1s^2 2s^1, litium memiliki satu elektron di kulit terluarnya yang cenderung dilepaskan untuk mencapai konfigurasi gas mulia helium yang stabil. Oleh karena itu, litium memiliki kecenderungan untuk melepaskan elektron, bukan menarik elektron tambahan.
Afinitas Elektron Klorin (Cl)
Klorin adalah unsur golongan halogen dengan afinitas elektron yang tinggi. Dengan konfigurasi elektron 1s^2 2s^2 2p^6 3s^2 3p^5, klorin hanya memiliki satu elektron tersisa pada kulit p terluarnya untuk mencapai konfigurasi gas mulia argon yang stabil. Oleh karena itu, klorin memiliki afinitas elektron yang tinggi karena cenderung menarik elektron tambahan dan membentuk ion negatif (Cl^-).
Afinitas Elektron Natrium (Na)
Natrium adalah unsur golongan alkali dengan afinitas elektron yang rendah. Dengan konfigurasi elektron 1s^2 2s^2 2p^6 3s^1, natrium memiliki satu elektron pada kulit s terluarnya yang cenderung dilepaskan untuk mencapai konfigurasi gas mulia neon yang stabil. Oleh karena itu, natrium memiliki kecenderungan untuk melepaskan elektron, bukan menarik elektron tambahan.
Hubungan Antara Afinitas Elektron dan Elektronegativitas
Afinitas elektron dan elektronegativitas adalah dua konsep yang saling terkait dalam kimia. Kedua konsep ini digunakan untuk menggambarkan kecenderungan suatu atom untuk menarik elektron dalam ikatan kimia.
Afinitas Elektron dan Pembentukan Ikatan Ionik
Afinitas elektron berperan penting dalam pembentukan ikatan ionik antara logam dan non-logam. Ketika logam kehilangan elektron, afinitas elektron non-logam yang tinggi menyebabkan non-logam menarik elektron tersebut dan membentuk ion negatif. Interaksi elektrostatik antara ion positif dan ion negatif membentuk ikatan ionik yang kuat.
Sebagai contoh, dalam pembentukan natrium klorida (NaCl), natrium melepaskan satu elektron, membentuk ion positif (Na^+), dan klorin menarik elektron tersebut, membentuk ion negatif (Cl^-). Interaksi elektrostatik antara ion Na^+ dan ion Cl^- membentuk ikatan ionik yang kuat dalam kristal garam.
Afinitas Elektron dan Elektronegativitas dalam Ikatan Kovalen
Elektronegativitas adalah ukuran kecenderungan suatu atom untuk menarik elektron dalam ikatan kovalen. Konsep ini juga terkait dengan afinitas elektron, karena afinitas elektron yang tinggi menunjukkan elektronegativitas yang tinggi.
Dalam ikatan kovalen, dua atom non-logam berbagi pasangan elektron. Jika satu atom memiliki afinitas elektron yang lebih tinggi dan menarik elektron dengan lebih kuat, atom tersebut akan memiliki elektronegativitas yang lebih tinggi. Hal ini menghasilkan pembentukan ikatan kovalen polar, di mana elektron lebih condong mendekati atom yang lebih elektronegatif.
Sebagai contoh, dalam ikatan antara hidrogen (H) dan klorin (Cl) dalam senyawa hidrogen klorida (HCl), klorin memiliki afinitas elektron yang lebih tinggi dan lebih elektronegatif dibandingkan dengan hidrogen. Oleh karena itu, pasangan elektron dalam ikatan lebih condong mendekati klorin, sehingga ikatan menjadi polar dengan muatan parsial negatif pada klorin dan muatan parsial positif pada hidrogen.
Peran Afinitas Elektron dalam Reaksi Kimia
Afinitas elektron memainkan peran penting dalam reaksi kimia. Kecenderungan suatu atom untuk menarik atau melepaskan elektron dapat mempengaruhi jalannya reaksi dan reaktivitas suatu senyawa.
Afinitas Elektron dalam Reaksi Oksidasi dan Reduksi
Dalam reaksi oksidasi dan reduksi (redoks), afinitas elektron mempengaruhi kecenderungan suatu unsur untuk menerima atau melepaskan elektron. Unsur dengan afinitas elektron yang tinggi cenderung berperan sebagai agen reduktor, yaitu cenderung melepaskan elektron. Sedangkan unsur dengan afinitas elektron yang rendah cenderung berperan sebagai agen oksidator, yaitu cenderung menerima elektron.
Sebagai contoh, dalam reaksi antara seng (Zn) dan asam klorida (HCl) untuk menghasilkan gas hidrogen (H2) dan garam seng klorida (ZnCl2), seng bertindak sebagai agen reduktor. Seng memiliki afinitas elektron yang rendah dan cenderung melepaskan dua elektron untuk membentuk ion seng positif (Zn^2+). Elektron yang dilepaskan oleh seng direduksi oleh ion hidrogen dalam asam klorida, membentuk gas hidrogen.
Afinitas Elektron dan Kestabilan Senyawa
Afinitas elektron juga dapat mempengaruhi kestabilan suatu senyawa. Senyawa dengan afinitas elektron yang tinggi cenderung lebih stabil karena atom-atomnya cenderung menarik elektron dengan kuat dan membentuk ikatan yang kuat.
Sebagai contoh, senyawaair (H2O) memiliki afinitas elektron yang tinggi. Oksigen dalam air memiliki afinitas elektron yang tinggi karena cenderung menarik pasangan elektron yang dibagikan oleh dua atom hidrogen. Hal ini menghasilkan ikatan kovalen polar yang kuat antara atom oksigen dan hidrogen dalam air. Kekuatan ikatan ini memastikan kestabilan molekul air.
Sebaliknya, senyawa yang memiliki afinitas elektron rendah cenderung kurang stabil. Misalnya, gas mulia seperti helium (He) memiliki afinitas elektron yang sangat rendah karena sudah memiliki konfigurasi elektron gas mulia yang sangat stabil. Hal ini menjadikan helium sangat tidak reaktif dan cenderung tidak membentuk senyawa dengan unsur lain.
Afinitas Elektron dan Sifat-sifat Fisik Senyawa
Afinitas elektron juga dapat mempengaruhi sifat-sifat fisik suatu senyawa, termasuk titik lebur, titik didih, dan kelarutan. Sifat-sifat ini dapat dipahami melalui interaksi antara molekul dalam senyawa yang dipengaruhi oleh afinitas elektron.
Pengaruh Afinitas Elektron pada Titik Lebur dan Titik Didih
Afinitas elektron dapat mempengaruhi titik lebur dan titik didih suatu senyawa karena mempengaruhi kekuatan ikatan antara molekul dalam senyawa tersebut.
Senyawa dengan afinitas elektron yang tinggi cenderung memiliki titik lebur dan titik didih yang tinggi. Hal ini disebabkan oleh adanya interaksi elektrostatis yang kuat antara molekul-molekul yang saling menarik elektron dengan kuat. Interaksi ini membutuhkan energi yang lebih besar untuk memutus ikatan dan mengubah fase senyawa menjadi cair atau gas.
Sebagai contoh, air (H2O) memiliki afinitas elektron yang tinggi dan membentuk ikatan hidrogen antara molekul-molekulnya. Ikatan hidrogen ini sangat kuat dan membutuhkan energi yang tinggi untuk memutusnya. Oleh karena itu, air memiliki titik didih yang relatif tinggi pada suhu 100 °C.
Di sisi lain, senyawa dengan afinitas elektron yang rendah cenderung memiliki titik lebur dan titik didih yang rendah. Hal ini disebabkan oleh interaksi yang lebih lemah antara molekul-molekul tersebut.
Pengaruh Afinitas Elektron pada Kelarutan
Afinitas elektron juga dapat mempengaruhi kelarutan suatu senyawa dalam pelarut. Kelarutan dipengaruhi oleh interaksi antara molekul pelarut dan molekul senyawa yang akan dilarutkan.
Senyawa dengan afinitas elektron yang tinggi cenderung lebih larut dalam pelarut polar yang memiliki afinitas elektron yang serupa. Interaksi elektrostatis antara molekul senyawa dan molekul pelarut memudahkan molekul senyawa untuk terlarut.
Sebagai contoh, garam meja (natrium klorida, NaCl) memiliki afinitas elektron yang tinggi dan mudah terlarut dalam air, yang merupakan pelarut polar dengan afinitas elektron yang tinggi. Air dapat melarutkan ion-ion Na^+ dan Cl^- dalam garam meja karena interaksi elektrostatis yang kuat antara ion-ion tersebut dan molekul air.
Di sisi lain, senyawa dengan afinitas elektron yang rendah cenderung kurang larut dalam pelarut polar. Interaksi yang lebih lemah antara molekul senyawa dan molekul pelarut membuat senyawa kurang mampu terlarut.
Afinitas Elektron dalam Reaksi Redoks
Afinitas elektron memainkan peran penting dalam reaksi redoks, di mana terjadi transfer elektron antara unsur-unsur. Afinitas elektron mempengaruhi kecenderungan suatu unsur untuk menerima atau melepaskan elektron dalam reaksi ini.
Afinitas Elektron dalam Oksidasi
Unsur dengan afinitas elektron yang rendah cenderung berperan sebagai agen oksidator dalam reaksi redoks. Agen oksidator cenderung menerima elektron dari unsur lain dan mengalami oksidasi dalam proses tersebut.
Sebagai contoh, dalam reaksi antara klorin (Cl2) dan natrium (Na), klorin bertindak sebagai agen oksidator. Klorin memiliki afinitas elektron yang rendah dan cenderung menerima elektron untuk membentuk ion klorida (Cl^-). Dalam reaksi ini, natrium kehilangan elektron dan mengalami oksidasi menjadi ion natrium positif (Na^+).
Afinitas Elektron dalam Reduksi
Unsur dengan afinitas elektron yang tinggi cenderung berperan sebagai agen reduktor dalam reaksi redoks. Agen reduktor cenderung melepaskan elektron kepada unsur lain dan mengalami reduksi dalam proses tersebut.
Sebagai contoh, dalam reaksi antara besi (Fe) dan tembaga (Cu), besi bertindak sebagai agen reduktor. Besi memiliki afinitas elektron yang rendah dan cenderung melepaskan elektron kepada ion tembaga positif (Cu^2+). Dalam reaksi ini, besi mengalami oksidasi menjadi ion besi positif (Fe^2+) sementara tembaga menerima elektron dan mengalami reduksi.
Penggunaan Afinitas Elektron dalam Industri
Afinitas elektron memiliki berbagai aplikasi dalam industri kimia. Peran afinitas elektron dalam reaktivitas dan pembentukan ikatan kimia dapat dimanfaatkan dalam produksi bahan kimia dan pengembangan material baru.
Pembuatan Bahan Kimia
Afinitas elektron dapat digunakan dalam produksi bahan kimia, seperti dalam proses sintesis senyawa organik. Pengetahuan tentang afinitas elektron suatu unsur dapat membantu dalam merancang reaksi kimia yang efisien untuk menghasilkan senyawa target.
Sebagai contoh, dalam sintesis obat-obatan, pengetahuan tentang afinitas elektron dan reaktivitas berbagai unsur dapat digunakan untuk memilih reagen yang tepat dan mengoptimalkan reaksi kimia. Dengan memahami afinitas elektron, para ahli kimia dapat merancang jalur sintesis yang efisien dan menghasilkan senyawa dengan tingkat kemurnian yang tinggi.
Pengembangan Material Baru
Afinitas elektron juga penting dalam pengembangan material baru. Dalam pemilihan bahan dan desain material, pengetahuan tentang afinitas elektron dapat membantu dalam memprediksi sifat-sifat material dan memilih material yang sesuai untuk aplikasi tertentu.
Sebagai contoh, dalam pengembangan material semikonduktor, pengetahuan tentang afinitas elektron suatu unsur dapat membantu dalam memilih unsur atau campuran unsur yang tepat untuk mencapai sifat semikonduktor yang diinginkan. Afinitas elektron yang tinggi dapat memastikan transfer elektron yang efisien dan konduktivitas yang baik dalam material semikonduktor.
Kesimpulan
Afinitas elektron adalah konsep penting dalam kimia yang berkaitan dengan kemampuan suatu atom untuk menarik elektron tambahan. Konsep ini membantu dalam memahami sifat-sifat unsur, reaktivitas kimia, dan pembentukan ikatan kimia. Afinitas elektron dipengaruhi oleh faktor-faktor seperti ukuran atom, muatan inti, dan konfigurasi elektron.
Afinitas elektron memiliki peran penting dalam reaksi kimia, termasuk reaksi oksidasi dan reduksi. Afinitas elektron juga mempengaruhi sifat-sifat fisik dan kimia suatu senyawa, seperti titik lebur, titik didih, dan kelarutan. Dalam industri kimia, afinitas elektron digunakan dalam produksi bahan kimia dan pengembangan material baru.
Dengan memahami afinitas elektron, kita dapat mengembangkan pemahaman yang lebih dalam tentang sifat-sifat unsur, reaktivitas kimia, dan pemilihan material yang tepat. Konsep afinitas elektron juga penting dalam pendidikan kimia dan penelitian ilmiah di bidang kimia.
Dalam pemahaman afinitas elektron, penting untuk melihat contoh-contoh konkret yang mengilustrasikan konsep ini. Beberapa contoh contoh afinitas elektron yang telah dibahas sebelumnya, seperti afinitas elektron fluorin yang tinggi dan afinitas elektron litium yang rendah, membantu kita memahami bagaimana afinitas elektron mempengaruhi sifat kimia unsur dan reaktivitas mereka.
Selain itu, afinitas elektron juga terkait erat dengan konsep elektronegativitas. Elektronegativitas menggambarkan kecenderungan suatu atom untuk menarik pasangan elektron dalam ikatan kovalen. Atom dengan afinitas elektron yang tinggi cenderung memiliki elektronegativitas yang tinggi, sementara atom dengan afinitas elektron rendah cenderung memiliki elektronegativitas yang rendah. Konsep ini memainkan peran penting dalam memahami sifat ikatan kimia dan polaritas senyawa.
Dalam konteks reaksi redoks, afinitas elektron juga mempengaruhi kecenderungan suatu unsur untuk menerima atau melepaskan elektron. Unsur dengan afinitas elektron tinggi cenderung berperan sebagai agen reduktor, sementara unsur dengan afinitas elektron rendah cenderung berperan sebagai agen oksidator. Konsep ini penting dalam pemahaman reaksi redoks dan aplikasinya dalam berbagai industri, seperti industri kimia dan pemrosesan bahan.
Dalam industri kimia, pengetahuan tentang afinitas elektron digunakan dalam produksi bahan kimia dan pengembangan material baru. Dalam sintesis senyawa organik, pemahaman afinitas elektron membantu dalam merancang reaksi kimia yang efisien untuk menghasilkan senyawa target. Dalam pengembangan material, afinitas elektron digunakan untuk memprediksi sifat-sifat material dan memilih material yang sesuai untuk aplikasi tertentu.
Dalam kesimpulan, memahami afinitas elektron adalah penting dalam mempelajari kimia secara mendalam. Konsep ini membantu dalam memahami sifat-sifat unsur, reaktivitas kimia, pembentukan ikatan kimia, dan sifat-sifat fisik dan kimia senyawa. Afinitas elektron dipengaruhi oleh faktor-faktor seperti ukuran atom, muatan inti, dan konfigurasi elektron. Dalam reaksi kimia, afinitas elektron mempengaruhi reaktivitas dan peran unsur dalam reaksi redoks. Dalam industri kimia, afinitas elektron digunakan dalam produksi bahan kimia dan pengembangan material baru. Dengan memahami konsep afinitas elektron, kita dapat memperluas pemahaman kita tentang dunia kimia dan penerapannya dalam berbagai bidang.
